深刺“环跳”在大鼠坐骨神经损伤修复中的抗凋亡机制
闫泓池1 陶星2 马铁明13 白增华3 郭秀婷4
(1东北国际医院,2武汉市中医院,3辽宁中医药大学针灸推拿学院,辽宁中医药大学附属医院沈阳110032)
摘要:选用SPF级SD大鼠,随机分成空白组、模型组、深刺组、浅刺组,每组12只。采用硅胶管卡压法制成大鼠坐骨神经慢性损伤模型。两个针刺组在高频超声引导下针刺“环跳”穴,其中深刺组在超声图中观察针尖触及神经干引发神经冲动,浅刺组针尖触及肌肉层下约5-8mm,超声图显示针尖未触及神经干,然后连接电针仪治疗。检测大鼠坐骨神经功能指数(SFI)和运动神经传导速度,HE染色法观察坐骨神经病理形态的改变,Tunel法观察细胞凋亡情况,免疫组化法检测大鼠L4-L5背根神经节中PI3K、AKT的表达。结果显示:模型组SFI、运动神经传导速度低于空白组,损伤坐骨神经细胞凋亡数以及L4-L5背根神经节中PI3K、AKT的表达高于空白组(均P<0.05)。两个针刺组SFI、运动神经传导速度、损伤坐骨神经细胞凋亡数与模型组相比均发生逆转(P<0.05),L4-L5背根神经节中PI3K、AKT的表达较模型组进一步升高(P<0.05),且深刺组各项指标的变化较浅刺组更显著(均P<0.05)。提示深刺“环跳”穴可以通过激活PI3K-AKT信号通路,抑制大鼠坐骨神经损伤后的神经细胞凋亡,促进神经损伤修复。
关键词:坐骨神经损伤;深刺;环跳穴; 细胞凋亡;PI3K-AKT
Abstract: Purpose: Discussing that deep insertion the acupuncture point- Huantiao has an effect on repairing the rat’s nervi ischiadicus by activation PI3K/AKT signaling pathway to affect the antiapoptosis. Method: Choosing SPF-SD rats, divided 48 into 4 groups randomly: blank group, model group, deep insertion group and shallow insertion group, each group with 12 rats. The nerve chronic damage model of the rat’s nervi ischiadicus is established by the silicone tube extrusion. With the ultrasonographic, Observing the nerve impulses which is caused by the needlepoint touching the nerve stem because being guided by the high frequency ultrasound, the deep insertion rats’ Huantiao are needled to the nervi ischiadicus. By the same way, the shallow insertion rats’ are needled with 5mm and the needlepoint doesn’t touch the nerve stem and be treated by the electric acupuncture.The rat’s nervi ischiadicus function index is detected by SFI. The velocity of the motor nerve conduction is detected cal by the nerve electrophysiological examination. The rat’s nervi ischiadicus pathological form change is detected by HE staining. The rat’s cell apoptosis is detected by TUNEL. The rat’s the expression of PI3K, AKT and Bcl-2 in L4 - L5 segmental spinal cord is detected by immunohistochemical method. Result: SFI: the model group is lower than the blank group(P<0.05), the deep and the shallow insertion groups are higher than the model group(P<0.05), the deep insertion group is higher than the shallow insertion group. The nerve electrophysiological examination: the model group is lower than the blank group(P<0.05), the deep and the shallow insertion groups are higher than the model group(P<0.05), the deep insertion group is higher than the shallow insertion group(P<0.05). HE staining: The model group rats’ nerve fibers are mixed and disorderly and the medullary sheath becomes Valle degenerescence and has more schwann cells. But being treated by the acupuncture, these conditions get better and has some new nerve fibers. The deep insertion group is better than the shallow insertion group.TUNEL: The model group is higher than the blank group(P<0.05), the deep and the shallow insertion groups are lower than the model group(P<0.05), the deep insertion group is lower than the shallow insertion group(P<0.05).The immunohistochemical method:The model group is higher than the blank group(P<0.05), the deep and the shallow insertion groups are higher than the model group(P<0.05), the deep insertion group is higher than the shallow insertion group(P<0.05). Conclusion: Deep insertion the acupuncture point- Huantiao could inhibit the apoptosis of nerve cell of the rat’s nervi ischiadicus by activation PI3K/AKT signaling pathway by needling the HuanTiao.
坐骨神经损伤的再生修复一直被医学界认为是较棘手的问题 [1]。随着运用细胞分子生物学技术对雪旺细胞[2]、神经营养因子、成纤维细胞生长因子等[3-4]的深入的研究,使得坐骨神经损伤再生修复的机制研究得到了飞速的发展。坐骨神经轴突损伤后引发神经元细胞凋亡,从而抑制周围神经损伤的修复[5-6]。如何抑制神经元细胞的凋亡,重新激活神经的自我再生能力,是基础研究和临床治疗的热点和难点[7-10]。运用中医针灸治疗周围神经损伤经过大量的临床和实验研究,已被证明是一种行之有效的方法[11-15]。
按照中医理论,针灸通过疏通经络,活血化瘀的作用来促进周围神经的再生修复。按照解剖学和生物学的理论,针刺皮下不同组织部位,如肌肉组织或神经干,其产生的效应会有所不同,体现了针刺深度是影响针刺刺激量和针刺疗效的重要因素。这在中医古代的经典文献中也有论述[16]。临床上治疗坐骨神经痛时,医者多以长针刺入环跳穴,并询问患者是否有向足部走行的传电感,以此来提高针刺的治疗效果[17]。这种传电感实际是针尖对环跳穴下的坐骨神经刺激而引起。
本课题组前期围绕与细胞凋亡和生长密切相关的几个分子物质进行了深刺“环跳”穴治疗坐骨神经损伤的相关作用机制研究。结果表明,针刺对坐骨神经损伤大鼠脊髓病理形态学变化有明显改善作用, 能提高神经干电活动指数;电针刺激"环跳"穴下方不同深度的组织可以不同程度提高损伤部位抗凋亡基因 Bcl-2 的表达,并减少促凋亡基因 Bax 的表达[18];下调坐骨神经损伤大鼠L4-L5脊髓p-JNK和p-c-jun表达水平,抑制JNK信号转导通路激活,保护神经元细胞[19];增加修复损伤神经物质NGF蛋白的表达,调节Fos蛋白水平[20]。这些可能是环跳穴深刺触及神经干疗效优于浅刺非神经干肌肉层的机制之一。本实验依靠高频小动物超声仪,对针刺深度进行可视性精确定位,以针尖触及穴下神经干引发强烈的神经冲动为针刺深度标准,从细胞凋亡相关的PI3K-AKT信号通路角度进一步探讨“环跳“穴”不同针刺深度对治疗效果的影响及其机制。
1 材料与方法
1.1 动物及分组
SPF级SD大鼠48只,体重300±50g,月龄2-3个月,雌雄各半,购自辽宁长生生物技术有限公司(许可证号SCXK(辽)2016-0001)。于辽宁中医药大学实验动物中心饲养,饲养环境的温度为20~25℃,湿度45%。实验中对大鼠的各项处理方法均根据国家医学实验动物管理条例执行,遵守实验动物管理及伦理委员会相关规定。大鼠购入后按照随机数字表法随机分成空白组、模型组、深刺组、浅刺组,每组12只。
1.2 主要试剂和仪器
苏木素伊红(HE)染色试剂盒、PI3K兔多抗、AKT兔多抗、免疫组化试剂盒(武汉博士德生物工程有限公司),原位末端标记(TUNEL)试剂盒(Promega公司),Vevo2100高分辨率小动物超声影像系统(加拿大 Visual Sonics公司),BL-420 生物技能实验系统(成都泰盟电子有限公司),“华佗牌”毫针0.3 mm×15 mm及SDZ-Ⅱ型电子针疗仪(苏州针灸用品厂),Meta Morph显微图像分析系统(日本Olympus),SRGSD荧光显微镜(德国LEICA),BX41 型数码显微镜(日本Olympus ),RM2235 型切片机(德国LEICA),长5mm、内管直径1.0mm、外管直径2.0mm的硅胶管(河北宝瑞橡胶制品有限公司)。
1.3 动物分组处理
空白组:与其他组相同条件正常饲养,并做与针刺组相同的固定处理。
模型组:采用Mackinnon等人[21-22]的方法制作大鼠坐骨神经卡压慢性损伤模型。以10%水合氯醛腹腔注射(3ml/kg)麻醉大鼠,将大鼠侧卧位固定于手术台,进行常规褪毛、备皮及消毒。在左下肢大腿股骨中点0.5cm处,与坐骨神经走行方向平行,用手术剪剪开皮肤切口长约1cm,将下肢肌肉经肌间钝性分离,暴露并游离出坐骨神经,将提前消毒的硅胶管沿硅胶管长轴方向切开,套住坐骨神经,用8-0医用手术缝合线将硅胶管缝合3针固定,使坐骨神经受到硅胶管环形挤压,在坐骨神经卡压处用注射器滴入庆大霉素注射液0.4ml,缝合伤口并用碘伏消毒。术后大鼠常规喂养,保持鼠笼清洁干燥。
深刺组:造模第15d起,将大鼠固定于大鼠固定器上,参照《实验针灸学》常用动物穴位定位法[23]取“环跳”穴(左后肢股骨大转子与尾骨、髂骨结合部连线外1/3与内2/3的交点处),以毫针针刺,(如图1所示:在小动物超声影像的引导下,黄色粗箭头为硅胶管卡压坐骨神经位置,黄色细箭头为超声引导下针刺位置),在高频小动物超声下观察到针尖触及坐骨神经干的瞬间,神经干出现抽动,此时记录的针刺深度为12-14mm(见图1)。连接电针治疗仪的一极,另外一极以医用胶布绑定于鼠尾制成无关电极。采用疏密波,频率为2/100Hz,电流约1mA,电针15 min,每日1 次,连续治疗14d。
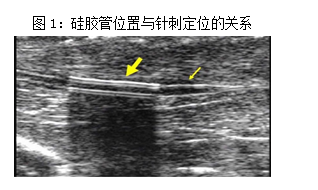
浅刺组:造模第15d起,与深刺组同样的方法针刺治疗,只是仅将针刺入肌肉层,不触及神经干,针刺深度为5-8mm。
1.4 造模成功的标准
造模后第14d测定大鼠神经传导速度,当损伤模型MNCV降低到20m/s左右,确定神经损伤模型成功。
1.5 观察指标及方法
1.5.1 坐骨神经功能指数
参照Bain JR和Oliveira EF等人[24-25]方法,分别于造模第14、28d测量。自制大鼠足印行走箱,长60cm,宽10cm,高15cm,箱底放置同等长度和宽度的白纸,通道远端放置一个鼠箱,一侧开门。SFI测定前,确保大鼠足印行走箱内部黑暗环境。测定前先用碳素墨水刷染大鼠双后足,将大鼠置于行走箱起始端,使其向远端行走,清晰记录大鼠双后足足印6-7个,计算时取其均值(见图2)。等待含有足印的纸条晾干,用高分辨率扫描仪复制印记并在计算机上存储。选实验侧(左侧)足底印记(E)、正常侧(右侧)足底印记(N),足印测定3个变量(见图2):足印长度(PL)、足趾宽度(TS)、中间足趾距离(IT),每组数据测量精确到毫米,测得数据代入Bain公式,计算各组大鼠SFI:
SFI=-38.3(EPL-NPL)/NPL+109.5(ETS-NTS)/NTS +13.3 (EIT-NIT)/NIT-8.8。SFI=0为正常,SFI=-100为神经完全离断损伤。

1.5.2 运动神经传导速度
分别于造模第14、28d检测坐骨神经MNCV。大鼠腹腔注射麻醉,俯卧位固定于手术台上,将神经电生理检测仪器的银质针刺激电极分别置于大鼠左侧坐骨切迹与髂骨尾骨联合处(解剖学下坐骨神经的位置所在)和左侧踝关节外侧皮肤,记录电极放在大鼠左足大趾与第二趾骨间肌肉附着处。波宽0.1ms的单脉冲方波刺激,反复调整刺激强度,以复合动作电位出现或消失时的刺激强度为刺激阈值。以1.5倍阈值作为刺激强度进行测定,每2个刺激之间间隔5s以上。将大鼠后足以自然肢体状态与脊柱成45°夹角向斜后方拉直,沿坐骨神经经过部位和方向,在大鼠体表分别量取两个银质针刺激电极到记录电极之间的距离。代入公式:MNCV(m/s)=两银质针刺激电极与记录电极之间距离差/两银质针刺激电极与记录电极之间的传导时间差。
1.5.3 取材过程
末次针刺后,称量大鼠体重,采用过量麻醉法处死大鼠,依次取损伤处坐骨神经、L4-L5背根神经节。参照大鼠造模方法,将大鼠俯卧位固定于手术台上,在左下肢大腿股骨中点0.5cm处,与坐骨神经走行方向平行,用手术剪剪开皮肤切口长约1cm,将下肢肌肉经肌间钝性分离,暴露并游离出坐骨神经,截取损伤处上下共约1cm坐骨神经。然后再将大鼠背部正中皮肤和肌肉纵向切开并剥离,分离肌肉组织,暴露椎管,截取L4-L5背根神经节。各组大鼠随机抽取6例样本浸泡于4% 多聚甲醛溶液中固定,4℃保存用于本研究指标检测。其余样本冻存于-80℃冰箱中用于其他实验检测。
1.5.4 坐骨神经病理形态学观察
病理切片的制备包括脱水、浸蜡、包埋、切片、HE染色、封片等步骤,最后在光镜下观察。
1.5.5 TUNEL法检测坐骨神经细胞凋亡
将石蜡切片常规脱蜡后,用双蒸水、0.05mol/L PBS (pH7.6)冲洗;用20mg/L蛋白酶K 37℃水浴槽内消化30min,用PBS冲洗;室温下放置10min,每张切片滴加TUNEL反应液50μL (TdT酶溶液和地高辛标记的核苷酸混合物溶液于使用前按比例混合),置于37℃湿盒中孵育60min;室温下终止反应,PBS冲洗后碱性磷酸酶转换液37℃孵育30min;PBS冲洗后加NBT + BCIP,显色5~30min;冲洗、透明、封片。荧光显微镜下计数凋亡细胞。
1.5.6免疫组化法检测背根神经节PI3K、AKT的表达
取出固定好的背根神经节用梯度浓度的乙醇进行脱水,二甲苯中透明, 浸蜡、包埋、切片,切片厚度4-5μm,然后进行脱蜡,按照免疫组化检测试剂盒说明进行操作,透明、封片后选择染色良好区域,应用显微图像分析系统,每只大鼠观察3张切片,每张切片选取5个互不重叠视野,测定单位面积阳性细胞表达的光密度值,取平均值。
1.6统计学分析
所有数据采用SPSS 17.0 软件进行统计学处理,结果以均数±标准差(±S)表示,多组间比较采用方差分析,组间比较若方差齐选用LSD 法,方差不齐选用非参数检验,p<0.05 为差异有统计学意义的标准。
2 结果
2.1 坐骨神经功能指数
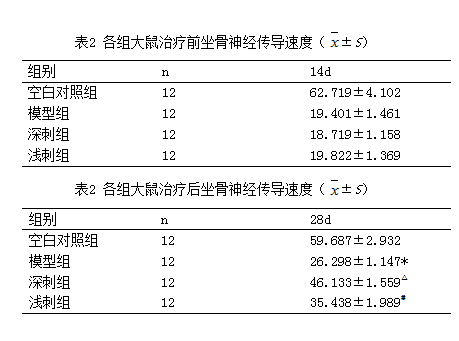
与空白组比较,模型组的SFI明显低于空白组(P<0.01),说明大鼠的运动功能减退且造模成功。而治疗组SFI明显高于模型组(P<0.01)。深刺组SFI明显高于浅刺组(P<0.01)。

注:与空白组相较,*P<0.01;与模型组比较,△#P<0.01;与浅刺组相较,△P<0.01
Fig 1 Effect of deep and shallow stab stimulation of“Huantiao" (GB 30) on the SFI of the injured sciatic nerve in rats
Upper panel:examples of the SFI of the sciatic nerve in the groups showing increases of SFI following EA intervention compared to the model group; Lower panel:comparison of the SFI of the sciatic nerve in rats of the normal,model,deep EA and shallow EA groups
2.2 神经电生理观察
与空白组相比较,模型组的神经传导速度明显低于空白组(P<0.05),提示造模成功。测定大鼠神经电生理均显示模型组和治疗组MNCV值存在显著性的差异,治疗组神经传导速度明显高于模型组(P<0.05)。而深刺组和浅刺组相比,深刺组的神经传导速度明显高于浅刺组(P<0.05)。
注:与空白组相较,*P<0.05;与模型组比较,△#P<0.05;与浅刺组相较,△P<0.05
Fig 2 Effect of deep and shallow stab stimulation of“Huantiao" (GB 30) on the MNCV of the injured sciatic nerve in rats
Upper panel: examples of the MNCV of the sciatic nerve in the groups showing increases of MNCV following EA intervention compared to the model group; Lower panel:comparison of the MNCV of the sciatic nerve in rats of the normal,model,deep EA and shallow EA groups
2.3 各组大鼠坐骨神经HE染色观察
空白组坐骨神经的神经纤维排列整齐、且轴突、髓鞘连续性很好,神经纤维周围有少量雪旺细胞存在;与空白组相比较,神经纤维排列呈不规则、紊乱的形式,且神经纤维周围的雪旺细胞增加,有瓦勒变性,轴突和髓鞘发生裂解,几乎完全消失。治疗组神经纤维的病理变化相对较轻,神经纤维出现新的生长。深刺治疗组病理变化程度要优于浅刺治疗组。
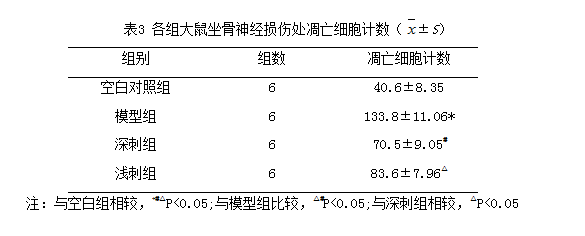
Fig 3 Pathological changes of the damaged sciatic nerve shown by HE staining in different groups(X400)
In the model group, tissues surrounding the damaged nerve showed obvious inflammatory cell infiltration, proliferation of Schwann cells(indicated by black arrowheads),disorganized nerve fibers and axons (yellow arrowheads).
2.4 各组大鼠坐骨神经损伤处凋亡细胞计数
TUNEL法标记结果显示:凋亡的神经元显示为细胞皱缩明显,细胞核固缩,或细胞破裂成碎片状;空白组未见标记的凋亡细胞,治疗组标记的凋亡细胞数明显少于模型组(P<0.05),深刺组细胞凋亡数低于浅刺组,差异具有统计学意义(P<0.05)
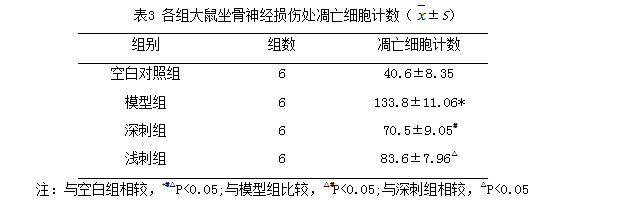
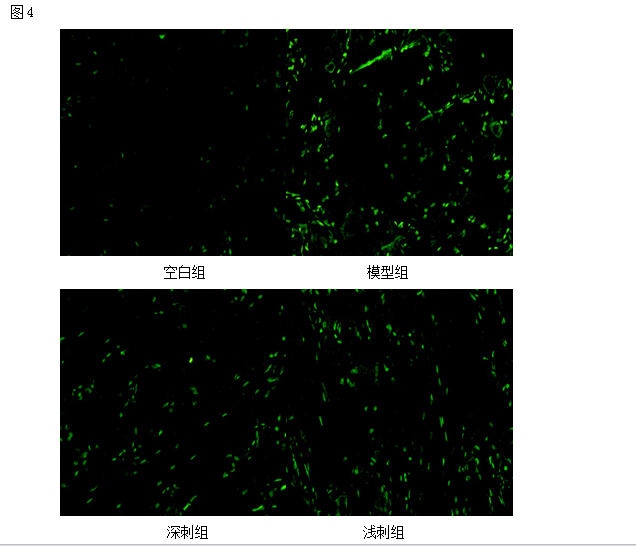
图4 各组大鼠神经细胞凋亡计数
Fig 4 Effect of deep and shallow stab stimulation of“Huantiao" (GB 30) on the count of cell apoptosis of the injured sciatic nerve in rats.
Upper panel:photos of stain showing the count of cell apoptosis of the sciatic nerve in the normal,model,deep EA and shallow EA groups(X 200);Lower panel:bar graphs showing the expression levels of the count of cell apoptosis of the sciatic nerve in each group (x±s,12 rats/group).
△P<0.05,与正常组比较(vs the normal group); #P<0.05,与模型组比较(vs the model group); ○P<0.05,与浅刺组比较(vs the shallow EA group).
2.5各组大鼠L4-L5背根神经节中“AKT”免疫组化表达情况:(平均光密度)
应用免疫组化检测“AKT”的表达情况。结果显示:与空白组相比较,各组大鼠L4-L5背根神经节中“AKT”表达均显著上调(P<0.05);治疗组与模型组相比较,治疗组大鼠L4-L5背根神经节中“AKT”蛋白表达显著上调(P<0.05);深刺组与浅刺组相比较,深刺组的大鼠L4-L5背根神经节中“AKT”蛋白表达高于浅刺组(P<0.05)。
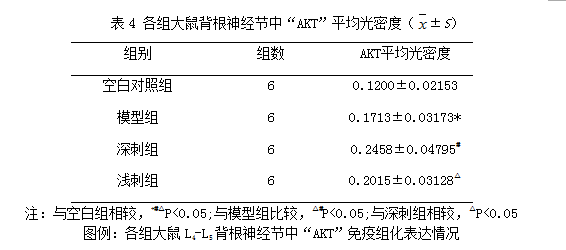
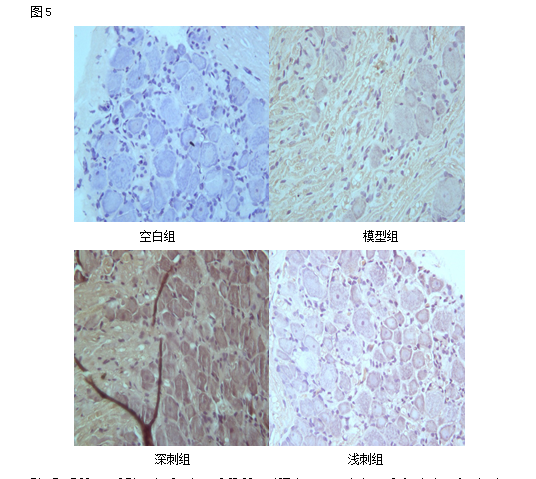
Fig 5 Effect of EA stimulation of GB 30 on AKT immunoactivity of the injured sciatic nerve in rats
Upper panel:photos of immunohistochcmical stain showing the expression of AKT of the sciatic nerve in the normal,model,deep EA and shallow EA groups(X 400);Lower panel:bar graphs showing the expression levels of AKT of the sciatic nerve in each group (x±s,12 rats/group).△P<0.05,与正常组比较(vs the normal group); #P<0.05,与模型组比较(vs the model group); ○P<0.05,与浅刺组比较(vs the shallow EA group).
2.6各组大鼠L4-L5背根神经节中“PI3K”免疫组化表达情况:(平均光密度)
应用免疫组化检测“PI3K”的表达情况。结果显示:与空白组相比较,各组大鼠L4-L5背根神经节中“PI3K”表达上调(P<0.05);治疗组与模型组相比较,治疗组大鼠L4-L5背根神经节中“PI3K”蛋白表达显著上调(P<0.05);深刺组与浅刺组相比较,深刺组的大鼠L4-L5背根神经节中“PI3K”蛋白表达高于浅刺组(P<0.05)。
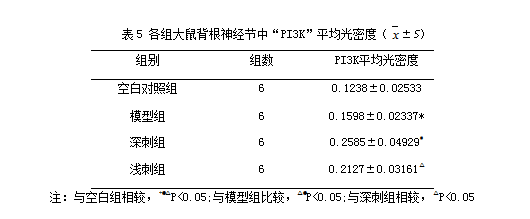
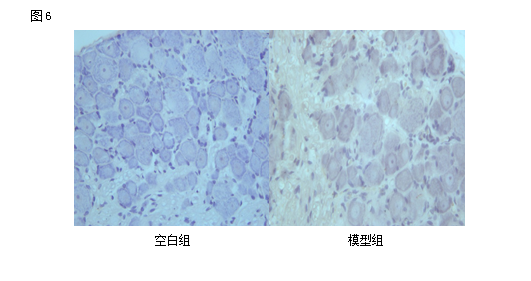
Fig 6 Effect of EA stimulation of GB 30 on PI3K immunoactivity of the injured sciatic nerve in rats
Upper panel:photos of immunohistochcmical stain showing the expression of PI3K of the sciatic nerve in the normal,model,deep EA and shallow EA groups(X 400);Lower panel:bar graphs showing the expression levels of PI3K of the sciatic nerve in each group (x±s,12 rats/group).
△P<0.05,与正常组比较(vs the normal group); #P<0.05,与模型组比较(vs the model group); ○P<0.05,与浅刺组比较(vs the shallow EA group).
3 讨论
如今,中医治疗周围神经损伤已经被认为是一种有效的治疗手段。针灸作为祖国医学重要的一部分,以其疗效显著,副作用少而得到了广泛的应用。本实验选取“环跳”穴作为研究对象,从中医理论来讲:坐骨神经损伤属于“痹症、痿症”的范畴。“环跳”穴位于足少阳胆经上,根据十二经脉主治原则“经络所过,主治所及”,此穴主要用于腰腿疼痛,下肢痿痹等症状[26-28]。而从解剖学角度来看,环跳穴下是臀大肌、梨状肌,梨状肌下就是坐骨神经。针刺一定深度可以触及坐骨神经干,为研究深浅刺提供科学的依据。深浅刺法一直以来受到临床研究的广泛关注。临床上治疗坐骨神经痛时,医者多用长针进针,并询问患者是否有酸、麻、胀、痛甚至有传电感,以此来提高针灸的治疗效果。但是在动物实验中,实验人员无法从动物身上获得与临床患者相互交流的信息,因此本实验依靠高频小动物超声的可视性指导下,明确了深刺的定义,深刺环跳触及穴下神经干,引发强烈的神经冲动,都是在超声影像中清晰可见的。本实验采用Mackinnon设计的硅胶管卡压造成的神经慢性损伤模型,此模型被认为是经典的研究神经卡压损伤模型。其他急性损伤模型造成大鼠自噬现象极为严重,硅胶管卡压模型属于慢性损伤,整个病理改变过程是缓慢进行的。应用小动物高频超声指导下进行深浅刺的定位,利用硅胶管在小动物高频超声下呈现条状高回声,可以明确坐骨神经的卡压损伤处便于深刺进针。
周围神经损伤修复一直以来被医学界公认为是最棘手的医学难题之一,修复过程较慢且难度较大。但是神经损伤是可以修复的,主要体现在运动功能恢复和神经传导两个方面。由于动物的应答的局限性,本实验采用检测大鼠坐骨神经功能指数来评价大鼠损伤神经的运动功能恢复。实验结果表明深刺触及神经干引发的神经冲动可以加快大鼠患侧肢体运动功能的恢复。神经电生理评价主要是反映神经的传导功能。本实验采用神经传导速度检测来评价坐骨神经损伤程度以及恢复情况。实验结果表明深刺神经干所引发的神经冲动可以更好的提高神经传导功能的恢复。
周围神经损伤后,其神经元细胞遵循细胞自身设定的程序,主动结束细胞本身的生命称之为细胞凋亡。而周围神经损伤说到底是属于细胞损伤的范围,因为神经元本身是一个完整的细胞组织,因此在神经修复的过程中,细胞凋亡起到了重要的作用。神经损伤后,会导致细胞凋亡因子的释放,使得神经元细胞逐渐凋亡。所以抑制凋亡因子释放进而减少神经元细胞凋亡是影响神经的再生和修复关键所在。如今有关凋亡的途径及其机制的研究很多,其中以PI3K-AKT信号通路近年来受到了较多的关注。PI3K-AKT信号通路主要调节bcl-2家族成员的活性,其中bcl-2是抑制细胞凋亡蛋白而Bad属于促进细胞凋亡蛋白。PI3K-AKT信号通路可以使得bcl-2因子呈游离态,发挥其抑制凋亡作用,同时Bad因子失活,防止其促进凋亡细胞,从而促进损伤神经的修复[29-30]。
从实验结果中我们可以推论出针刺修复周围神经损伤的作用机制可能与针刺通过激活信号通路PI3K-AKT释放抑制细胞凋亡因子有关,从而防止神经元细胞凋亡,对周围神经再生,保护神经元胞体,促进神经再生研究具有一定的意义。
综上所述,针灸深刺触及神经干治疗周围神经损伤取得较好的疗效关键在于触及神经干后,引发强有力的神经冲动反应,产生较强的刺激量,恢复了神经功能的传导。针刺通过激活信号通路PI3K-AKT释放抑制细胞凋亡因子,从而防止神经元细胞凋亡,对周围神经再生,保护神经元胞体,促进神经再生研究具有一定的意义。
参考文献
[1] Geuna S, Raimondo S, Ronchi G, et al. Histology of the peripheral nerve and changes occurring during nerve regeneration. Int. Rev. Neurobiol. 2009; 87:27–46.
[2] Kawai H, Yasuda H,Terada M, et al. Axonal Contact Regulates Expression of a2 and β2 Isoforms of Na+ , K+,-ATPase in Schwann Cells; Adhesion Molecules and Nerve.Regeneration[J]. Journal of Neurochemistry, 1997, 69(1):330-339.
[3] Semkova I, Krieglstein J. Neuroprotection mediated via neu-rotrophic factors and induction of neurotrophic factors [J].Brain Research Reviews, 1999,30(2):176-188.
[4] Frostick SP, Yin Q, Kemp GJ. Schwann cells, neurotrophic factors, and peripheral nerve regeneration [J]. Microsurgety, 1998,18(7):397-405.
[5] Neuronal death in the dorsal root ganglion after sciatic nerve injury does not depend on sortilin.Gürgör P, Pallesen LT, Johnsen L, Ulrichsen M, de Jong IE, Vaegter CB.Neuroscience. 2016, 319:1-8. doi: 10.1016/j.neuroscience.2016.01.036.
[6] Changes of GTP cyclohydrolase I and neuronal apoptosis in rat spinal dorsal cord induced by sciatic nerve injury.Meng C, Liang X, Li Q, Chen G, Liu H, Li K.Neurol Sci. 2013, 34(12):2145-2150. doi: 10.1007/s10072-013-1353-5.
[7] MiR-21 and miR-222 inhibit apoptosis of adult dorsal root ganglion neurons by repressing TIMP3 following sciatic nerve injury.Zhou S, Zhang S, Wang Y, Yi S, Zhao L, Tang X, Yu B, Gu X, Ding F.Neurosci Lett. 2015;586:43-49. doi: 10.1016/j.neulet.2014.12.006.
[8] Protective effects and anti-apoptotic role of nerve growth factor on spinal cord neurons in sciatic nerve-injured rats.Lu XM, Shu YH, Qiu CH, Chen KT, Wang YT.Neurol Res. 2014;36(9):814-23. doi: 10.1179/1743132814Y.0000000333.
[9] Nanoparticles carrying neurotrophin-3-modified Schwann cells promote repair of sciatic nerve defects.Zong H, Zhao H, Zhao Y, Jia J, Yang L, Ma C, Zhang Y, Dong Y.Neural Regen Res. 2013;8(14):1262-8. doi: 10.3969/j.issn.1673-5374.2013.14.002.
[10] Let-7 microRNAs regenerate peripheral nerve regeneration by targeting nerve growth factor.
Li S, Wang X, Gu Y, Chen C, Wang Y, Liu J, Hu W, Yu B, Wang Y, Ding F, Liu Y, Gu X.Mol Ther. 2015 ;23(3):423-33. doi: 10.1038/mt.2014.220.
[11 ]Direct current electrical stimulation of acupuncture needles for peripheral nerve regeneration: an exploratory case series.Inoue M, Katsumi Y, Itoi M, Hojo T, Nakajima M, Ohashi S, Oi Y, Kitakoji H.Acupunct Med. 2011 Jun;29(2):88-93. doi: 10.1136/aim.2010.003046. Epub 2011 Feb 28.
[12] What are the main points in acupuncture treatment of peripheral nervous injuries?Zhang P.J Tradit Chin Med. 2004 Mar;24(1):43. No abstract available.
[13] A survey on acupuncture treatment of peripheral nerve injury.Shao Y, Shan B.J Tradit Chin Med. 1999 Sep;19(3):221-6. Review. No abstract available.
[14] Electro-acupuncture on functional peripheral nerve regeneration in mice: a behavioural study.
Hoang NS, Sar C, Valmier J, Sieso V, Scamps F.BMC Complement Altern Med. 2012 Aug 31;12:141. doi: 10.1186/1472-6882-12-141.
[15] The effects of electroacupuncture on peripheral nerve regeneration in rats.Inoue M, Hojo T, Yano T, Katsumi Y.Acupunct Med. 2003 Jun;21(1-2):9-17.
[16] 陆永辉.《灵枢》经脉针刺深度探析[J],针灸临床杂志,2012,28(7):12-13.
[17] 邢淑琴. 针刺环跳穴治疗坐骨神经痛62例疗效观察[J]. 天津中医学院学报,J Tianjin Univ Tradit Chin Med 2002,21(3):35.
[18] Dai L1, Han Y2, Ma T3, Liu Y3, Ren L3, Bai Z3, Li Y4.Effects of Deep Electroacupuncture Stimulation at "Huantiao" (GB 30) on Expression of Apoptosis-Related Factors in Rats with Acute Sciatic Nerve Injury.Evid Based Complement Alternat Med. 2015;2015:157897. doi: 10.1155/2015/157897. Epub 2015 Jun 17.
[19]刘宪彤; 陶星; 马铁明; 马贤德; 闫泓池; 田琳; 刘泮泮电针“环跳”穴不同组织对坐骨神经损伤大鼠脊髓JNK、c-jun磷酸化表达的影响2015(5)
[20]刘玉丽; 李野; 任路; 戴丽丽; 白增华; 白茹; 马铁明深刺“环跳”穴对大鼠损伤坐骨神经的修复作用2014(2)
[21] Mackinnon SE, Dellon A, Hudson AR, et al. A primate modelfor chronic nerve compression [J]. J Reconstr Microsurg, 1985,1(3): 185-195
[22] O'Brien JP, Mackinnon SE, MacLean AR,et al.A model ofchronic nerve compression in the rat[J].Ann Plast Surg,1987,19(5):430-435.
[23] 余曙光,徐斌.实验针灸学.北京:人民卫生出版社.2012:269.
[24] Bain JR, Mackinnon SE, Hunter DA. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat. Plast Reconstr Surg 1989;83(1):129/36.
[25] Oliveira EF, Mazzer N, Barbieri CH, Selli M. Correlation between functional index and morphometry to evaluate recovery of the rat sciatic nerve following crush injury:experimental study. J Reconstr Microsurg 2001;17(1):69 /75.
[26] 王剑,翁明军,周道琴. 坐骨神经损伤修复机制及治疗效果分析[J]. 中国实用神经疾病杂志,2013,19:53-54.
[27] 陈大为,高乐女,邱玲. 针刺神经干治疗坐骨神经痛研究进展[J]. 四川中医,2007,01:40-42.
[28] 王磊,于天源. 针刺治疗周围神经损伤的研究进展[J]. 中国医药指南,2012,12:77-78.
[29] Ha Neui Kim,Yu Ri Kim,Ji Yeon Jang,et al.Electroacupuncture inhibits phosphorylation of spinal phosphatidylinositol 3-kinase/Akt in a carrageenan-induced inflammatory rat model.Brain Research Bulletin,2012,87:199-204
[30] AZhenChen,Zhicheng Lin,Lan lan,et al.Electroacupuncture at the Quchi and Zusanli acupoints exerts neuroprotective role in cerebralischemia-reperfusion injured rats via activation of the PI3K/Akt pathway.International Journal of Molecular Medicine,2012, 30:791-796

 世界针灸学会联合会
世界针灸学会联合会