隔药灸对克罗恩大鼠结肠和中枢DA/D1R表达的影响
陆 嫄1、2,吕婷婷1 ,徐曼文3,马 喆1,翁志军1,冯 辉4,吴 璐一1 ,张 方1 ,丁光宏2 ,吴焕淦1 ,刘慧荣1
(1 上海市针灸经络研究所,上海,200030;2 复旦大学,上海,200120;3.上海中医药大学附属龙华医院,上海,200032;3 上海市光华中西医结合医院,上海,200433)
摘要:目的:DA是免疫系统中一种有效的免疫调节剂,在各种免疫相关疾病中DA浓度和/或DRs表达的改变,导致机体发生不同的免疫过程。本研究旨在观察隔药饼灸天枢穴(双)、气海穴对克罗恩大鼠靶器官结肠、中枢脊髓背角和下丘脑中DA/D1R调节作用,从该角度阐释隔药饼灸治疗克罗恩病的机制。方法:三硝基苯磺酸(TNBS)灌肠制备大鼠克罗恩病模型,随机分成1.正常组(Normal Group,NG);2.模型组(Model Group, MG);隔药灸组(Herbal-partitioned Moxibustion group,Mox);4.美沙拉嗪组(Mesalazine,Mesa)。隔药灸组取穴天枢(双)、气海;药饼配方:附子、肉桂、丹参、黄连等药研末后加适量黄酒,制成直径1、厚0.5cm大小药饼,上置约小艾炷施灸,每次每穴各灸2壮,每日1次,连续治疗10天。美沙拉嗪组采用美沙拉嗪溶液灌胃,每日2次,共10天。治疗结束后,测定大鼠结肠大体损伤评分,HE染色观察结肠病理改变;免疫组织化学检测大鼠结肠黏膜DA/D1R的表达;ELISA检测大鼠脊髓背角和下丘脑DA/D1R含量;Real-time PCR检测结肠黏膜、脊髓背角和下丘脑D1R mRNA的表达情况。结果:HE染色结果显示模型组大鼠结肠黏膜层有明显裂隙状溃疡形成,深达黏膜下层,固有层间质、黏膜下层结缔组织明显水肿伴大量淋巴细胞浸润,黏膜下层可见结节病样肉芽肿形成;与模型组比较,隔药灸组和美沙拉嗪组大鼠结肠组织不同程度恢复。免疫组织化学和ELISA结果显示,与正常组比较,模型组结肠、脊髓背角、下丘脑DA/D1R的表达均显著增高(P<0.01),与模型组比较,隔药灸组和美沙拉嗪组DA/D1R表达均显著降低(P<0.01,P<0.05);PCR结果显示,与正常组比较,模型组结肠、脊髓背角、下丘脑D1R mRNA表达显著增高(P<0.01),与模型组比较,隔药灸组和美沙拉嗪组D1R mRNA的表达均显著降低(P<0.01)。结论:隔药灸天枢、气海穴能够缓解克罗恩病大鼠结肠炎症,促进结肠组织病理损伤的修复,能够降低克罗恩病大鼠靶器官结肠、中枢脊髓背角和下丘脑组织DA/D1R mRNA的表达,发挥炎症抑制作用,这可能是隔药灸治疗克罗恩病的重要机制之一。
关键词:针灸学;克罗恩病;隔药灸;多巴胺;多巴胺受体
Effects of Herbal-Partitioned Moxibustion on DA/D1R Expression in the Colon and Central Nervous System using a Rat Model of Crohn's Disease
Yuan Lu1,2, Tingting Lv1, Manwen Xu3, Zhe Ma1, Zhijun Weng1, Hui Feng4, Luyi Wu1, Fang Zhang1, Guanghong Ding2, Huangan Wu1, Huirong Liu1
(1. Shanghai Institute of Acupuncture-Moxibustion and Meridian. 650 South WanPing Road, Shanghai, China. 200030; 2. Department of Mechanics and Engineering Science, Fudan University. 220 Handan Road, Shanghai, China. 200433; 3. Longhua Hospital, Shanghai University of Traditional Chinese Medicine. 725 South WanPing Road, Shanghai, China. 200030; 4. Guanghua Hospital. 540 Xinhua Road, Shanghai, China. 200052)
Abstract: Objective: To observe dopamine (DA)/dopamine receptor D1R in the colon, spinal dorsal horn and hypothalamus of a rat model of Crohn's disease (CD) by moxibustion at the Tian-shu(ST25)and Qi-hai(CV6)acupoints and to elucidate the mechanism of moxibustion in treating CD. Methods: The rats were randomly divided into the normal, model, herbal-partitioned moxibustion (Mox) and mesalazine (Mesa) groups. Damage in the colons was scored and observed by HE staining. DA/D1R expression in the colonic mucosa was detected by immunohistochemistry, which in the spinal dorsal horn and hypothalamus were measured by ELISA. D1R mRNA expression in the three sites was evaluated by real-time PCR. Results: Immunohistochemistry and ELISA results showed that DA/D1R expressions were significantly higher in the model group than in the normal group (P<0.01), and decreased in the Mox and Mesa groups compared to the model group (P<0.01, P<0.05). PCR showed the same results of D1R mRNA expression as DA/D1R.. Conclusion: Moxibustion at the Tian-shu (ST25) and Qi-hai (CV6) acupoints can relieve colitis in a CD rat, decrease DA/D1R mRNA expression in the intestine, spinal dorsal horn and hypothalamus. The anti-inflammatory effect may be important mechanisms underlying the efficacy of moxibustion on CD.
Keywords:Acupuncture, Crohn's disease, Herbal-partitioned moxibustion, Dopamine, Dopaminereceptor
克罗恩病(CD)属于临床常见的炎症性肠病(IBD),发病机制尚未清楚,目前普遍认为IBD的发生是由于环境、遗传易感性和异常肠道微生物免疫反应等多因素之间的相互作用而产生的病理性肠道炎性反应[1,2]。目前针对IBD的常用治疗药物如氨基水杨酸、激素、免疫抑制剂等不但疗效有限,副作用也往往较高[3]。灸法作为针灸疗法重要的组成部分,有其独特的优势和不可替代的作用,灸法在现代临床中用于治疗CD显示出很好的疗效[4,5]。临床研究也已证实,针灸疗法在改善CD活动指数和患者生活质量方面优势明显,可以作为辅助疗法用于轻、中度活动期CD的治疗[6]。我们团队多年从事针灸治疗CD的临床与基础研究工作,已通过实验证实,采用天枢、气海为主穴的隔药灸治疗轻、中型CD,近期有效率达72.7%[7,8];在临床有效的基础上,我们采用TNBS灌肠制备CD大鼠模型[9],开展针灸治疗CD的可能作用机制研究,发现针灸可以显著改善CD大鼠肠组织病理损伤,降低血清与结肠组织多种炎性因子如TNF-α、TGF-β、FGF、 CTGF、IGF (IGF-I)及其受体、IGFBP-5[10-13]等的异常表达。
DA对IBD小鼠肠道炎症具有重要的调节作用[14],DA作为神经递质,其异常升高与炎症的免疫应答过程有密切关系,艾灸可能通过影响交感神经的兴奋性,使DA含量下降。DA含量下降又有利于炎症局部血液循环改善,促使炎症因子的转运和清除,从而缓解炎症状态[15]。持续的炎症刺激作用于肠上皮导致肠黏膜屏障功能改变进而导致肠黏膜屏障的损伤,与细胞因子和炎性介质密切相关。炎症信息可以通过海马单胺类递质活动的介导作用,改变下丘脑神经内分泌的功能状态,最终影响HPA系统对伤害刺激的反应性。可见海马-HPA系统参与炎症与免疫反应的调节,。我们推测这条途径是艾灸抗炎免疫作用中一条重要的神经体液性调节途径。有研究表明,多巴胺在免疫细胞受体介导的信号通路可能参与了自身免疫性疾病的过程,多巴胺受体抑制剂可以改善自身免疫性疾病的症状[16]。前期研究提示,克罗恩病是灸法的一种有效肠腑病症,本研究旨在观察隔药饼灸对克罗恩大鼠靶器官结肠、中枢脊髓背角和下丘脑中DA/D1R调节作用,从该角度阐释隔药饼灸治疗克罗恩病的潜在的机制。
1 实验材料与方法
雄性Sprague-Dawley (SD)大鼠40只,体重(140±10) g,由上海中医药大学动物实验中心提供[实验动物许可证号:SYXK(沪)2004-2005]。室内温度(20±2)℃,相对湿度(60±10)%,自由饮食饮水,实验前适应性饲养3 d。完全随机分为:1.正常组(Normal Group,NG);2.模型组(Model Group, MG);隔药灸组(Herbal-partitioned Moxibustion group,Mox);4.美沙拉嗪组(Mesalazine,Mesa),每组10只。参照国际公认Morris法制作CD大鼠模型,即TNBS(2,4,6-trinitro-Benzenesulfonicacid,Sigma-Aldrich)合乙醇溶液灌肠。实验前禁食不禁水24h,1%戊巴比妥钠30mg/(kg.bw)腹腔麻醉,将5%(W/V)的TNBS与50%乙醇按2∶1体积比混合成灌肠液,按照3 mL/kg体重,于距肛门6~8 cm处注入灌肠液,每星期1次,共4次。第4次结束后的第7天,从各组中随机抽取1 只大鼠,麻醉后解剖并剪取大鼠耻骨联合处至盲肠处的结肠2 cm,观察结肠大体损伤并结合HE染色以鉴定模型制备是否成功。
穴位: 双侧天枢 (ST 25)、气海 (CV 6)。穴位定位参照《实验针灸学》[17]。药饼配方: 附子、肉桂、丹参、黄连等药研末后加适量黄酒调和,用模具制成直径0.5 cm、厚0.3 cm大小的药饼。造模结束后的第8天开始进行隔药灸治疗。用手轻轻抓取大鼠,腹部朝上,在双侧天枢 (ST 25)和气海 (CV 6)上置药饼,药饼上置约90 mg小艾炷进行施灸,每次每穴各灸2壮,每日1次,连续治疗10 d。美沙拉嗪组采用美沙拉嗪溶液灌胃。每日投药量按成人(70 kg体重,4 g/d) 与大鼠(200 g体重)换算系数0.018,得大鼠的剂量为0.36g/kg[18],每日2次,共灌胃10 d。各组治疗结束后,剔除每组中体重最轻的大鼠,将剩余大鼠进行检测观察,本实验结果为每组8只。
1.1 HE染色
治疗干预结束后,剪取大鼠耻骨联合处至盲肠处结肠,沿肠系膜纵行剖开,用放大镜进行观察。石蜡切片脱蜡至水;0.01mol/L PBS 冲洗5 min×2次;苏木素染色1 min;1%盐酸酒精分化3 s;伊红染色30 s;脱水后封片;滴加中性树胶封片。
1.2 免疫组化
石蜡切片进行微波加热抗原修复;0.01mol/L PBS(pH 7.4)冲洗5 min×3次;0.3%H2O2灭活内源性过氧化物酶;0.01mol/L PBS冲洗5 min×3次;滴加兔抗鼠DA、D1R一抗1:500,37℃孵育2 h,0.01M PBS冲洗5 min×3次;滴加浓度为1:500二抗,室温孵育30 min;0.01M PBS冲洗5 min×3次;滴加DAB显色液(EnVision,上海基因科技公司,中国),显微镜下控制显色时间;采用Motic图像分析系统分析阳性目标积分光密度(integral optical density, IOD)。
1.3 酶联免疫吸附试验(ELISA)
新鲜结肠黏膜组织匀浆离心后取上清液,加入100μl标准品、100μl已适当稀释标本于相应板孔中;加入100μl兔抗鼠DA;温育20分钟后洗板,加入100μl 1x HRP,洗板后每孔加入100μl TMB显色液,轻轻混匀10秒,每孔加入100μl终止液。轻轻混匀30秒,15分钟内脏450nm处读OD值。DA(ng/ml)=标准曲线上查出的浓度×标本的稀释倍数。
1.4 实时定量PCR(Real-time PCR)
从结肠组织中提取总RNA,用逆转录酶反应体系(上海基尔顿生物科技有限公司)合成cDNA,相对基因表达量由△△CT法来控制。以GAPDH为内参照,DA、D1R引物由Primer Express设计合成。ABI-7300 Real-time PCR仪(Applied Biosystems by Life Technologies,USA);Thermo,SYBR Green逆转录试剂盒(Thermo Fisher Scientific,USA);
2 统计方法
实验数据均采用统计学软件SPSS 18.0进行统计。采用单因素方差分析(One-way ANOVA)和最小显著性差异(least significant difference, LSD)法进行多重比较,用均数±标准差(±s)表示,检验结果有统计学意义则进一步采用Nemenyi法进行两两比较,检验水准为α=0.05。
3 结果
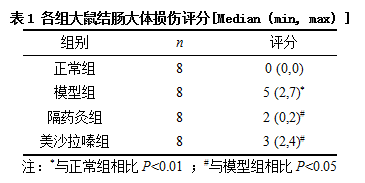
3.1 大鼠结肠大体损伤评分
CD大鼠结肠紫暗并粘连明显,局部肠道扩张增厚且伴粪便梗阻,纤维化程度较重,结肠黏膜欠光滑,伴充血、水肿、糜烂,可见多个点状、块状溃疡形成,重者可深达肌层;隔药灸组大鼠结肠质软色淡红,组织粘连程度有所改善,充血和水肿程度较模型大鼠也有所减轻。与模型组相比,隔药灸组、美沙拉嗪组评分显著降低(P<0.05),见表1。
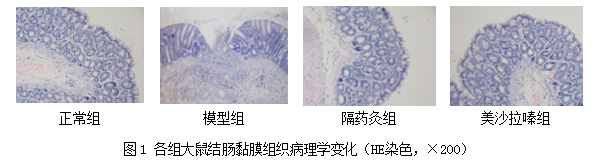
3.2 大鼠结肠黏膜组织病理学变化
正常组大鼠结肠结构完整,黏膜固有层及下层均未见水肿或增生,肠壁肌层、浆膜层完整;模型组结肠出现黏膜面溃疡,局部黏膜上皮缺失,裂隙状溃疡形成,固有层间质、黏膜下层结缔组织水肿,大量嗜酸性粒细胞和淋巴细胞浸润,部分黏膜下层形成结节病样肉芽肿并伴纤维增生;隔药灸组大鼠结肠组织可见溃疡愈合,充血水肿程度减轻,黏膜固有层增厚,杯状细胞增生;西药组大鼠结肠组织也呈现出同隔药灸治疗组类似的改善(图1)。
3.3 大鼠结肠黏膜神经递质DA、D1R/D1R mRNA表达
与正常组相比,模型组大鼠结肠黏膜下层嗜酸性粒细胞和淋巴细胞浸润周围呈阳性或强阳性反应(P<0.01),与模型组比较,隔药灸组和美沙拉嗪组结肠组织中受体阳性表达较不明显(P<0.01)(图2)。PCR结果可见:模型组大鼠结肠组织D1R mRNA表达量高于正常组大鼠(P<0.01),隔药灸组和美沙拉嗪组D1R mRNA表达较模型组明显降低(P<0.01)(图2)。
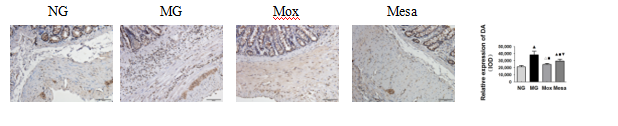
图2 各组大鼠结肠黏膜神经递质DA、D1R/D1R mRNA表达.
注:采用免疫组织化学和real-time PCR方法检测DA、D1R/D1R mRNA的相对表达。NG:正常组,MG:模型组,Mox:隔药灸组,Mesa:美沙拉嗪组。▲P<0.01,△P<0.05 vs NG;■P<0.01 vs MG,□P<0.05;▼P<0.01,▽P<0.05 vs Mox
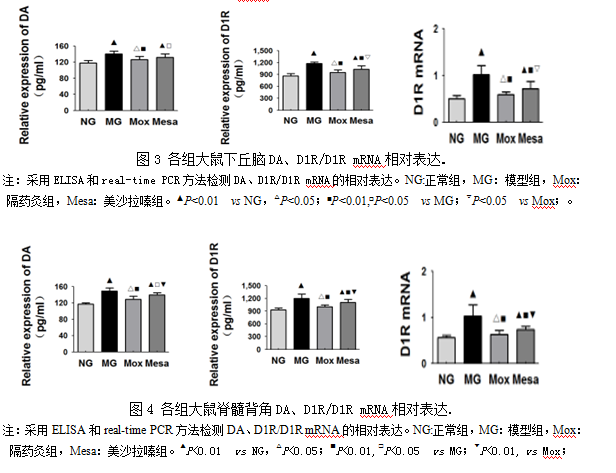
3.4 大鼠下丘脑与脊髓背角DA、D1R/D1R mRNA表达
ELISA结果发现:与正常组比较,模型组下丘脑与脊髓背角DA、D1R表达显著增高(P<0.05);与模型组比较,隔药灸组和美沙拉嗪组DA、D1R表达均显著下调(P<0.05)。通过PCR对下丘脑与脊髓背角D1R mRNA进行检测:模型组大鼠下丘脑与脊髓背角D1R mRNA表达量高于正常组大鼠(P<0.01),隔药灸组和美沙拉嗪组D1R mRNA表达较模型组明显降低(P<0.01)(图3,图4)。
4 讨论
针灸治疗的信息,可以通过外周的传入进入中枢神经系统进行整合,HPA轴作为一条重要的神经体液性调节途径在其中发挥重要作用,是目前发现的艾灸抗炎免疫作用中枢整合的一个重要环节[19]。多巴胺(Dopamine,DA)是一种重要的神经递质,在免疫系统中发挥有效的免疫调节作用,其受体可以表达在绝大多数的免疫细胞上,并能调节淋巴细胞、肥大细胞等免疫细胞的增殖与活化[20]。多巴胺作为神经递质广泛存在于外周组织中,但目前多巴胺对外周炎症反应的调控机制的研究还相对较少[15]。我们的研究发现,外周靶器官结肠组织在经过TNBS合乙醇溶液灌肠处理后,诱导出符合CD病理改变的结肠炎症表现(图1),同时CD大鼠结肠黏膜各层可见DA阳性表达明显增多,染色普遍较深,尤其在黏膜下层嗜酸性粒细胞和淋巴细胞浸润周围呈阳性或者是强阳性反应。隔药灸能够改善结肠炎性病理改变(图2),溃疡愈合,充血水肿程度减轻,黏膜固有层增厚,同时对升高的结肠DA水平具有下调作用(图2),通过real-time PCR方法对结肠组织D1R mRNA进行检测,CD大鼠结肠组织D1R mRNA相对表达量高于正常组大鼠,隔药灸对结肠D1R和D1R mRNA过高的表达都具有抑制的作用。多巴胺系统的损伤是IBD病理特征之一,多巴胺在炎症性肠病中具有保护作用的角色,我们的实验结果中,多巴胺在急性炎症阶段合成的增加,可能是多巴胺对肠道保护性作用的体现,当艾灸治疗对CD大鼠结肠炎症改善后,多巴胺水平有所下调,炎症进入慢性期。有研究[2,21]表明,多巴胺有具有保护细胞以及抑制血管通透性的作用,在动物实验中给予多巴胺受体激动剂可以减轻UC的相关症状,而在CD和UC患者的炎性肠道黏膜中可以发现多巴胺合成功能的受损,并认为多巴胺能系统可以通过控制血管通透性从而对IBD患者起到保护作用[22,23],隔药饼灸的作用与DA激动剂类似,通过临床角度进一步支持我们的发现。D2R 激动剂Quinpirole能够抑制IL-10敲除小鼠结肠炎症的慢性进展,明显改善UC大鼠结肠的病理损伤评分,这些发现都为多巴胺系统在IBD病理机制中的重要作用提供了并行的重要证据。
已有研究证明,在炎症性肠病过程中,HPA轴可以发生系统性反应[24],在我们的研究中,采用CD大鼠模型对艾灸的疗效和机制进行研究,涉及靶器官结肠、脊髓以及HPA轴中下丘脑。前面我们观察了CD大鼠结肠黏膜多巴胺及其受体表达情况,隔药饼灸对结肠黏膜多巴胺的含量具有明显的调节作用,而且促进了结肠炎性病变的修复进程,炎症部位细胞因子的释放可以刺激并影响下丘脑、垂体和肾上腺的细胞因子水平,HPA轴活动的增强对保证机体各组织器官对炎症应答和抗炎免疫是十分重要的,炎症信息可以改变下丘脑神经内分泌的功能状态,调整垂体激素和影响皮质激素的分泌,最终影响HPA系统对伤害刺激的反应性,所以我们对HPA轴下丘脑中DA及其受体D1R的表达情况进行检测,以探索隔药饼灸对CD大鼠发挥抗炎效应过程中可能存在的DA介导的途径“神经体液性调节途径”,实验结果发现,各组间下丘脑DA、D1R/D1R mRNA的表达均有差异,TNBS处理能够上调了下丘脑中DA、D1R/D1R mRNA的相对表达,在隔药饼灸缓解结肠炎症的同时,同样对下丘脑中DA、D1R/D1R mRNA的相对表达具有调节作用,可能是因为隔药饼灸通过降低结肠炎症细胞因子的释放,从而改变了下丘脑神经内分泌的功能状态,可以解释隔药饼灸促进炎症水平趋于缓解状态后,隔药饼灸组下丘脑DA、D1R/D1R mRNA的表达出现下调。也有研究表明,多巴胺在免疫细胞的受体介导的信号通路可能参与了自身免疫性疾病的过程[16],并且采用多巴胺受体抑制剂可以改善自身免疫性疾病的症状。为了观察隔药饼灸对HPA轴和靶器官的调节作用是通过局部DA?还是通过整体调节DA水平发挥作用?我们也检测了脊髓背角中DA、D1R/D1R mRNA含量的相对表达情况,结果发现,TNBS处理同样能够上调脊髓背角中DA、D1R/D1R mRNA的相对表达,隔药饼灸能够下调这种趋势。多巴胺D2受体(DRD2)敲除的小鼠可以在中枢神经系统(CNS)出现炎性反应,也表明多巴胺及其下游信号具有一定的抗炎作用[20]。针对交感神经在隔药饼灸抗炎效应中的作用在我们的实验中并未研究,这将在我们后期实验中展开讨论。
参考文献
[1] Bonaz BL, Bernstein CN.Brain-gut interactions in inflammatory bowel disease.Gastroenterology. 2013 Jan;144(1):36-49.
[2] Tolstanova,G.,et al. Role of Dopamine and D2 Dopamine Receptor in the Pathogenesis of Inflammatory Bowel Disease[J]. Digestive Diseases and Sciences, 2015. 60(10): 2963-2975.
[3] Lee D,Albenberg L,Compher C.,et al.Diet in the pathogenesis and treatment of inflammatory bowel diseases.Gastroenterology.2015 May;148(6):1087-106.
[4] Tao CH, Zhao JM, et al. Randomized controlled trial: moxibustion and acupuncture for the treatment of Crohn's disease. World J Gastroenterol, 2014, 20(31): 11000-11011.
[5] 施茵,包春辉,吴焕淦,等.隔药灸结合针刺对克罗恩病患者肠黏膜TNF-α、TNFR1、TNFR2表达及肠上皮细胞凋亡的影响[J].上海中医药杂志,2011,45(1):46-50.
[6] Joos S, Brinkhaus B, Maluche C, et al. Acupuncture and moxibustion in the treatment of active Crohn's disease: a randomized controlled study. Digestion, 2004, 69(3): 131-139.
[7] Wu HG, Zhang LS Clinical study of herbs-partition moxibustion on Crohn’s disease. Xiandai Kangfu, 2000, 4(3): 397.
[8] Shang HX, Wang AQ, Bao CH, et al Moxibustion combined with acupuncture increases tight junction protein expression in Crohn's disease patients. World J Gastroenterol, 2015, 21(16): 4986-4996.
[9] Morris GP, Beck PL, Herridge MS, et al Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology, 1989, 96(3):795-803.
[10] Ma XP, An CP, Wu HG,, et al Herbs-partitioned moxibustion and electro- acupuncture effects on transforming growth factor-beta 1, connective tissue growth factor, collagen type Ⅰ and fibronectin expression in the colon of Crohn's disease rats. J Clin Rehabilit Tis Engineer Res, 2008, 12(20): 3853-3858.
[11] Ma XP, An CP, Wu HG, et al Effects of herbs-partitioned moxibustion and electro-acupuncture on expressions of IGF-I, IGF-IR and IGF-BP5 in Crohn’s disease rats. Shanghai Zhenjiu Zazhi, 2008, 27(5): 37-40.
[12] Zhao C, Ding JY, Ma JD, et al Acupuncture on the basic fibroblast growth factor and type Ⅰ collagen in colons of rats with Crohn' s disease. J Acupunct Tuina Sci, 2011, 9(1): 1-6.
[13] Wu HG, Zhao C, Wu LY, et al Effect of moxibustion on expressions of TGF-β and smad4 in colonic mucosa of rats with intestinal fibrosis in Crohn disease. J Acupunct Tuina Sci, 2012, 10(6): 331-335.
[14] Rooks MG, Veiga P, Wardwell-Scott LH, et alGut microbiome composition and function in experimental colitis during active disease and treatment-induced remission.ISME J. 2014 Jul;8(7):1403-17.
[15] 李琳,李磊等.多巴胺对脂多糖诱导小鼠腹腔巨噬细胞炎症反应的影响[J]. 中华创伤杂志, 2016. 06(32).
[16] Kawano, M., et al Berberine is a dopamine D1- and D2-like receptor antagonist and ameliorates experimentally induced colitis by suppressing innate and adaptive immune responses[J]. Journal of Neuroimmunology, 2015. 289: 43-55.
[17] Yu SG, Guo Y. Experimental Acupuncture Science. Shanghai: Shanghai Scientific &Technical Publishers, 2009.
[18] Weng ZJ, Wu LY, Lü TT, et al Regulatory effects of herbal cake-partitioned moxibustion on the expressions of IL-17, IL-23 and their mRNAs in the colon of rats with Crohn’s disease. J Acupunct Tuina Sci, 2016, 14(3): 156-163.
[19] GAO Xiu-hua,WANG Xing-li,LIU Xu-guang, et alEffects of Different Moxibustion on the Function of HPAA in Rabbits with Rheumatoid Arthritis.Journal of Basic Chinese Medicine,2015,21(9):1140-1142.
[20] Yan,Y.,et al.,Dopamine Controls Systemic Inflammation through Inhibition of NLRP3 Inflammasome[J]. Cell, 2014. 160(1): 62-73.
[21] Herak-Perkovic, V., et al Effects of dopaminergic drugs on inflammatory bowel disease induced with 2,4-dinitrofluorbenzene in BALB/c mice[J]. J Vet Pharmacol Ther, 2001. 24(4): 267-73.
[22] Basu S, Nagy JA, Pal S, et al The neurotransmitter dopamine inhibits angiogenesis induced by vascular permeability factor/vascular endothelial growth factor. Nat Med. 2001;7:569–574.
[23] Sarkar C, Chakroborty D, Chowdhury UR, et al Dopamine increases the efficacy of anticancer drugs in breast and colon cancer preclinical models. Clin Cancer Res. 2008;14:2502-2510.
[24]Herfarth H, Brand K, Rath HC,, et al Nuclear factor-kappa B activity and intestinal infl ammation in dextran sulphate sodium (DSS)-induced colitis in mice is suppressed by gliotoxin. Clin Exp Immunol 2000; 120: 59-65.

 世界针灸学会联合会
世界针灸学会联合会