化瘀通络灸对VD大鼠延迟回忆及海马Nestin、DCX表达的影响
樊吟秋1,崔竟成1,杨 骏2,王 频3
(1 安徽中医药大学研究生部,合肥230038;2 安徽中医药大学第一附属医院,合肥230038;3 安徽中医药大学针灸骨伤临床学院,合肥230038)
摘要:研究目的:观察化瘀通络灸对VD大鼠NSCs、EPCs移植后延迟回忆及海马Nestin、DCX表达的影响,并探索其与脑内神经新生的关系。研究方法:选用雄性SPF级Wistar大鼠,Morris水迷宫筛选后随机分为假手术组、VD模型组、NSCs+EPCs艾灸组、NSCs+EPCs空白组。采用改良的2-VO法复制VD模型,NSCs、EPCs细胞培养后进行共植体构建,NSCs+EPCs艾灸组大鼠于模型鉴定后3天进行共移植体侧脑室移植,于移植后3d化瘀通络灸治疗,穴取百会、大椎、神庭。每穴悬灸20min,每天1次,7次为1疗程,共治疗3疗程,每疗程结束后休息1d,随后疗程连续治疗。运用Morris水迷宫测试各组大鼠延迟回忆成绩,免疫荧光双标激光共聚焦检测大鼠海马Nestin、DCX的表达。研究结果:Morris水迷宫结果显示,治疗后除VD模型组大鼠逃避潜伏期较治疗前无明显变化外(P>0.05),假手术组、NSCs+EPCs艾灸组、NSCs+EPCs空白组大鼠逃避潜伏期均较治疗前缩短(P<0.05);且NSCs+EPCs艾灸组大鼠120s内穿越原平台次数较治疗前增多(P<0.05)。NSCs+EPCs艾灸组大鼠逃避潜伏期较VD模型组缩短,穿越原平台次数较VD模型组增多(P<0.008);与NSCs+EPCs空白组相比,逃避潜伏期缩短(P<0.008)。免疫荧光结果显示,NSCs+EPCs艾灸组的阳性表达多于NSCs+EPCs空白组(P<0.05);其中Nestin、DCX分别在治疗1、2疗程后表达最多(P<0.05,P<0.05),结果有统计学意义。结论:化瘀通络灸可提高VD大鼠NSCs、EPCs移植后的延迟回忆,并通过上调海马区Nestin、DCX的表达,促进脑内神经新生。
关键词:化瘀通络灸;血管性痴呆;海马;延迟回忆;Nestin;DCX
Effect of Huayutongluo Moxibustion on the Delayed Memory of Vascular Dementia and the Expression of Nestin、DCX in the Hippocamopus
FAN Yin-qiu1,CUI Jing-cheng1,YANG Jun2,WANG Pin3
(1 The Department of Postgraduate Education,Anhui University of Traditional Chinese Medicine,Hefei 230038;2 1st Affiliated Hospital,Anhui University of Traditional Chinese Medicine,Hefei 230038;3 Anhui University of Traditional Chinese Medicine,Hefei 230038)
Abstract: Objective: To discuss the effect of Huayutongluo Moxibustion on the delayed memory of vascular dementia rats and the expression of Nestin、DCX in the hippocampus after the transplantation of NSCs+EPCs and then illustrate the relationship with neurogenesis. Methods: Male Wistar rats of SPF level were randomly separated into control group,model group,NSCs+EPCs moxibustion group and NSCs+EPCs control group. Improved 2-VO method was used to make the vascular dementia models. The lateral ventrcle of rats in NSCs+EPCs moxibustion group were transplanted into NSCs+EPCs after 3 days of models’ identification. Moxibustion was administered once daily for 7 consecutive days and had a rest for one day on rats in NSCs+EPCs moxibustion group. 7 days comprised a course of treatment and 3 courses were needed for treating. The Morris Water Maze was used to test the delayed memory of rats before and after 24 hours of the third course of treatment. The expression of Nestin and DCX was tested with double-labeled immunofluorescence technology. Results: The Morris Water Maze shows that the latency of all groups’ rats was definitely shorter than period before treatment(P<0.05)besides the VD model group(P>0.05),times of crossing the platform of NSCs+EPCs moxibustion group were definitely increased than period before treatmentin 120s(P<0.05). The latency of NSCs+EPCs moxibustion group was definitely shorter than model group but the times of crossing the platform were definitely increased than model group(P<0.008).The latency of NSCs+EPCs moxibustion group was definitely shorter than model group and NSCs+EPCs control group(P<0.008).The immunofluorescence shows that the positive expression in NSCs+EPCs moxibustion group′s rats was more than that in NSCs+EPCs control group(P<0.05).The expression of Nestin and DCX was respectively highest after the 1st and 2nd course of treatment(P<0.05,P<0.05). Conclusion: The delayed memory and the expression of Nestin and DCX of vascular dementia rats after transplanting NSCs+EPCs can be increased by Huayutongluo Moxibustion so that can promote neurogenesis.
Key words: Huayutongluo Moxibustion, Vascular dementia, Hippocampus, Delayed memory, Nestin, DCX
血管性痴呆(Vascular Dementia,VD)是指一种因脑血管病变造成脑部组织血流运行障碍,引起记忆、认知和行为改变的脑区低灌注性血管疾病,是一种慢性进行性疾病,表现为严重的认知功能障碍综合征[1]。目前VD的发病机制不明,在VD早期,核心症状为记忆障碍,尤以即刻记忆和延迟回忆障碍为主。近年来针刺已被证实可促使脑缺血大鼠海马、SVZ区巢蛋白(Nestin)、双皮质素(Doublecortin,DCX)表达增强,从而促进内源性神经干细胞(Neural Stem Cells,NSCs)增殖[2-7],并向神经元细胞分化[8],即促进神经新生;而化瘀通络灸可促进VD大鼠脑损伤要害部位的血管生成[9]。但针刺和艾灸对机体的调节可能是通过不同的传导通路实现的[10]。在此基础上,本研究使用增强绿色荧光蛋白(Enhanced Green Fluorescent Protein,EGFP)标记的慢病毒逆转录体外培养的NSCs,继而与内皮祖细胞(Endothelial Progenitor Cells,EPCs)构建共移植复合体,将构建成功的共植体进行目标大鼠侧脑室移植,模拟体内神经血管新生密切联系的微环境,通过观察化瘀通络灸对VD大鼠NSCs+EPCs后延迟回忆及海马区Nestin、DCX表达的影响,进一步探讨化瘀通络灸治疗VD的作用机制。
1. 材料与方法
1.1 动物与分组
1.1.1 行为学实验
雄性清洁(Special Pathogen Free,SPF)级Wistar大鼠55只,体重250-300g,由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2012-0001。实验室常温(25±1)℃适应性饲养1周以适应实验室环境。使用Morris水迷宫筛选出实验大鼠52只纳入实验分组,造模前随机分出12只作为假手术组,其余实验大鼠均采用分次双侧颈总动脉缺血再灌注后结扎剪断法制备VD模型。模型复制3天后,用Morris水迷宫进行模型鉴定,再次筛选出造模成功的合格痴呆大鼠36只,按随机数字表法分为3组,NSCs+EPCs艾灸组、NSCs+EPCs空白组、VD模型组,每组12只。实验过程中对动物的处理符合中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》。
1.1.2 免疫荧光实验
选用SPF级雄性Wistar大鼠60只,体重250-300g,喂养、实验前筛选、造模、模型鉴定方法同前,保留造模成功大鼠54只,随机分为3组:NSCs+EPCs艾灸组、NSCs+EPCs空白组、VD模型组,每组18只。4组动物根据移植后治疗的时相点进一步分为治疗1疗程后、2疗程后、3疗程后三个亚组,每亚组动物各6只。
1.2 主要实验试剂与仪器
1.2.1 主要试剂
EGFP逆转录病毒液(合肥泓衫生物科技);一抗鼠抗EGFP抗体(江苏恩莫阿赛);一抗兔抗Nestin(英国Abcam);一抗兔抗Doublecortin(英国Abcam);;荧光二抗羊抗鼠FITC(美国Santa cruz);荧光二抗羊抗兔TRITC(美国SIGMA)。
1.2.2 主要仪器
Morris水迷宫图像自动采集和软件分析系统(中国);OLYMPUS荧光显微镜/图像采集分析系统(日本);轻便型大鼠脑立体定位仪及其配套设备(中国RWD-68505);冰冻切片机(德国Leica-CM1900);激光共聚焦电子扫描显微镜(日本OLYMPUS);微型手持式颅钻及其配套设备(中国RWD-78001);水套式CO2培养箱(日本CO-175)。
1.3 模型制备与鉴定
1.3.1 模型制备
采用分次双侧颈总动脉缺血再灌注后结扎剪断法复制VD模型,大鼠术前12h禁食,4h禁水,用10%水合氯醛和25%乌拉坦的1:1混合麻药按5ml/1kg腹腔注射麻醉大鼠[11],待其浅反射消失后使其仰卧在自制鼠板上,固定,常规消毒,行颈正中切口,钝性分离颈总动脉。使用微动脉夹对右侧颈总动脉行缺血再灌注处理后分别在动脉近心端远心端结扎,从中间剪断,1周后再以相同方式处理左侧颈总动脉。后缝合伤口,局部使用庆大霉素注射液浸润,防止感染,分开放回笼中饲养。假手术组术前和术后操作与模型复制组大鼠相同,但只分离颈总动脉不做其他处理。
1.3.2 模型鉴定
造模后3天使用Morris水迷宫依次对各组大鼠进行模型鉴定。将假手术组大鼠定位航行实验第4天逃避潜伏期的平均值作为参考值,再将每只造模后大鼠在相同时间段逃避潜伏期的平均值与参考值比较,差异有统计学意义者为造模成功大鼠[12]。
1.4 NSCs+EPCs共植体侧脑室移植
用于实验的动物于模型鉴定完成后3d进行移植[13]。根据Wistar大鼠脑立体定位图谱[14]确定大鼠侧脑室方位参数(前囟后2.4 mm,中线侧旁开3.6mm,硬膜下3.5 mm)。
将培养的“NSCs+EPCs”共移植复合体溶解于0.01M PBS中,干细胞计数后将其浓度调整为2×106细胞/10μL,移植容量为每只大鼠10μL。
大鼠麻醉后脑立体定位仪固定,大鼠头部位置不会左右移动时视为固定良好。局部剃毛,平行头顶正中线手术刀微创切口,清理软组织至颅骨,统一选取右侧侧脑室为移植点,φ1.2mm颅骨钻开孔,微推进器推动微量注射器垂直进针,在进入3.5mm后缓慢匀速推入细胞悬液。注射在5-10min内完成,留针5min后缓慢拔针,石蜡封孔,缝合皮肤,庆大霉素注射液局部浸润防止感染。
1.5 治疗方法
各组大鼠于移植后3d开始治疗,NSCs+EPCs艾灸组大鼠放置于自制的灸架上,选取大椎、百会、神庭剃毛标记,穴位的选取参照大鼠穴位图谱,通过类比大鼠骨骼与体形,并参照人体腧穴位置确定。艾灸治疗需在大鼠清醒状态下进行,点燃自制的艾条(长12cm,直径5mm),每穴悬灸20min。每天1次,7d为1疗程,共治疗3疗程,每疗程结束后休息1d。治疗过程中动物常规饲养。
假手术组、VD模型组和NSCs+EPCs空白组处理时间与灸法组平行,只将实验动物置于灸架而不作其他任何处理。
1.6 观察指标及检测方法
1.6.1 Morris水迷宫测试延迟回忆
治疗3疗程结束后24h用Morris水迷宫进行行为学和延迟回忆测试。水迷宫为大鼠通用型,池壁涂一层黑色材料,水池四周悬挂黑色遮光布,减少光线对实验过程和结果的影响,同时保证光线柔和平衡以便于视频追踪。水温控制在(26±2)℃,池底部4个条形凸起将水池等分为一、二、三、四四个象限,选在第一象限靠近水池中心处放置高度为23cm,直径为10cm的透明圆形平台,平台没入水下2cm。将大鼠面向池壁放入水中,动作轻柔,避免大鼠应激反应对实验结果造成影响。
① 定位航行实验:定位航行实验的第1-3天,测试时先将受试大鼠放置在平台上熟悉环境30s,再依次将大鼠由第一、三、二、四象限入水点放入水中;第4天直接使受试大鼠依次由不同象限入水。每只大鼠在每个象限的受试时间为120s,记录大鼠在120s内寻找到水下平台的时间作为逃避潜伏期。大鼠在120s内找到平台,使其在平台上停留30s,30s内未跳下平台的记录120s内实际逃避潜伏期,若30s内跳下平台,则记录最后一次跳上平台的时间为逃避潜伏期,若大鼠120s内未找到平台,由实验者帮助其找到平台并停留30s,同时记录逃避潜伏期为120s。每只大鼠前后两次入水时间间隔约5min。定位航行实验进行4天,记录每天所有进行检测的动物每个象限的逃避潜伏期,并计算测试第一、二、三、四天逃避潜伏期的平均值及标准差,以第4天的成绩判断大鼠的延迟回忆能力。
② 空间探索实验:4天定位航行实验结束后,于次日进行空间探索实验。实验者撤去平台,然后选择第三象限相同的位置为入水点,保持大鼠面向池壁入水,测其第一次跨越原平台所在位置的时间为潜伏期,并记录120s内其跨越原平台所在位置的次数,以判断大鼠的长时记忆存储、延迟回忆再现能力。
1.6.2 免疫荧光双标激光共聚焦检测Nestin、DCX
① 脑组织取材:各组大鼠分别于第1疗程结束后、第2疗程结束后、第3疗程结束后24h三个时间点处死。麻醉大鼠,剪开胸腔暴露心脏,剪开心包膜,将灌注针从心尖处插入,经左心室固定在升主动脉,用输液皮条经过心脏灌注生理盐水直至流出液体变透明,再用4%多聚甲醛500ml先快后慢灌注固定,待大鼠躯体抽搐、变硬后继续灌注至500ml灌完。小心剥离大脑组织置于4℃、4%多聚甲醛中避光固定。
② 脑组织冰冻切片:取出在4%多聚甲醛中固定的脑组织,冰冻切片机切片。取脑组织中含有SVZ区,海马齿状回(Dentate Gyrus,DG)区、CA1区、CA3区的部位切片,厚度10um,贴片法固定于多聚赖氨酸处理的黏附载玻片。
③ 免疫荧光染色:切片固定抗原修复后,山羊血清封闭液封闭2h;吸去多余的封闭液,分别滴加一抗鼠抗EGFP(1:100)、一抗兔抗Nestin(1:100)、一抗兔抗DCX(1:100),4℃冰箱过夜;复温后0.01MPBST漂洗,5min×3次,晾干;分别避光滴加荧光二抗羊抗鼠FITC(1:200)、荧光二抗羊抗兔TRITC(1:500),37℃避光孵育2h;滴加DAPI复染细胞核,10min后0.5% PBST漂洗,5min×3次;滴加抗荧光淬灭封片剂,指甲油封片。阴性对照采用PBS代替一抗,余步骤不变。切片4℃避光保存。
④ 激光共聚焦检测Nestin、DCX:镜下寻找EGFP/Nestin、EGFP/DCX阳性标志物,取得最大荧光信号,高倍镜(400倍)下快速采集图像完成测定,运用Image J医学图像分析软件分析计算平均光密度(Mean Optical Density,MOD)值,对特异性蛋白进行半定量分析。
1.7 数据统计处理
采用国际通用统计软件SPSS22.0处理数据。数据先进性正态性检验,符合正态分布的数据选择两独立样本T检验或ANOVA单因素方差分析。进行单因素方差分析时,首先进行方差齐性检验,齐性检验水平α=0.1;符合方差齐的两两检验选择LSD检验,若方差不齐两两检验选择Dunnett T3检验,显著性水平均取α=0.05。不符合正态分布的数据选择Kruskal-Wallis H秩和检验,显著性水平取α=0.05;后续两两比较选择Mann-Whitney U检验,此时显著性水平取α′=2α/k(k-1),k为比较的组数。
2. 结果
2.1 Morris水迷宫测试结果
因人为设定定位航行实验最大潜伏期为120s导致结果出现大量截尾数据而不成正态分布,故分析选用Kruskal-Wallis H秩和检验,α=0.05,后续两两比较选择Mann-Whitney U检验,α′=2α/k(k-1),k为参与划分组数,此时α′=0.008。
模型鉴定第4天VD模型组、NSCs+EPCs艾灸组、NSCs+EPCs空白组大鼠的逃避潜伏期均较假手术组延长(P<α′=0.008);VD模型组、NSCs+EPCs艾灸组、NSCs+EPCs空白组大鼠的逃避潜伏期无统计学差异(P>0.008),见图1。模型复制成功且移植前无显著差异。
治疗后除VD模型组大鼠逃避潜伏期较治疗前无明显变化外(P>α=0.05),假手术组、NSCs+EPCs艾灸组、NSCs+EPCs空白组大鼠逃避潜伏期均较治疗前缩短(P<0.05);且NSCs+EPCs艾灸组大鼠120s内穿越原平台次数较治疗前增多(P<0.05)。NSCs+EPCs艾灸组大鼠逃避潜伏期较VD模型组缩短,穿越原平台次数较VD模型组增多(P<0.008),而NSCs+EPCs空白组大鼠逃避潜伏期与VD模型组无明显差异(P>0.008)。NSCs+EPCs艾灸组与NSCs+EPCs空白组相比,大鼠逃避潜伏期缩短(P<0.008),穿越原平台次数无明显差异(P>0.008)。说明相应的治疗均可在不同程度上提高VD大鼠的延迟回忆,但NSCs+EPCs艾灸组的治疗效果优于NSCs+EPCs空白组,见图2,图3。
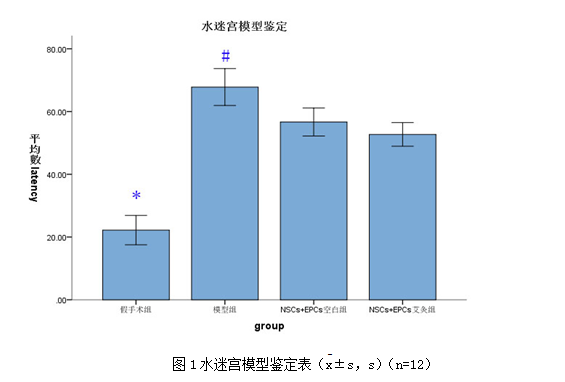
Fig1 The model identity of Morris Water Maze(±s,s)(n=12)
* P<0.008,与假手术组比较(vs the sham group)

图2定位航行实验第4天各组大鼠游泳的逃避潜伏期(±s,s)(n=12)
Fig2 The latency of the 4th day of visible platform experiment(±s,s)(n=12)
*P<0.05,与本组治疗前比较(vs before treatment in the same one group);#P<0.008,治疗组与VD模型组比较(treatment group vs the VD model group after treatment);▲P<0.008,NSCs+EPCs艾灸组与NSCs+EPCs空白组比较(NSCs+EPCs moxibustion group vs NSCs+EPCs control group after treatment)
图3空间探索实验各组大鼠穿越平台位置次数(±s,次)(n=12)
Fig3 The times of different groups′ rats in initial spatial experiment(±s,次)(n=12)
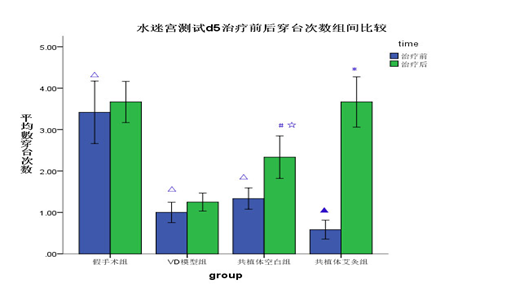
* P<0.05,与本组治疗前比较(vs before treatment in the same one group);# P<0.008,治疗组与VD模型组比较(treatment group vs the VD model group after treatment);
2.2 免疫荧光双标激光共聚焦检测Nestin、DCX表达
VD模型组镜下未找到阳性标记物,故不参与组内比较与组间比较。
经检验数据符合正态分布。平行疗程组间比较选用两独立样本T检验,显著性水平取α=0.05;组内不同疗程比较选择单因素方差分析,符合方差齐性的数据后续两两比较选择LSD检验,若方差不齐两两检验选择Dunnett T3检验,显著性水平均取α=0.05。
2.2.1 Nestin
NSCs+EPCs艾灸组在治疗2、3疗程后,大鼠海马区Nestin表达均较1疗程后减少(P<0.05),2、3疗程后两两比较无明显差异(P>0.05);且1、3疗程后Nestin表达均较平行疗程的NSCs+EPCs空白组增多(P<0.05),见图4、图5。说明化瘀通络灸可以促进VD大鼠海马区Nestin表达,但随着细胞移植时间的延长,表达会有下降的趋势。
图4海马区Nestin的MOD值(±s)(n=18)
Fig4 The MOD of Nestin in the hippocampus(±s)(n=18)
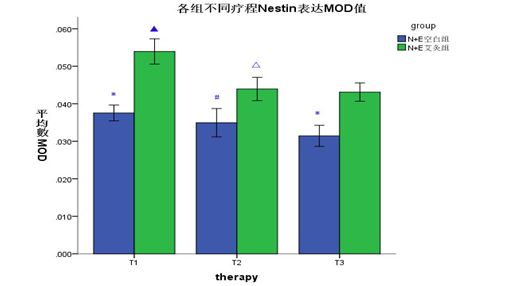
*P<0.05,与本组治疗1疗程后比较(vs therapy 1 in the same one group);# P<0.05,相同疗程的NSCs+EPCs艾灸组与NSCs+EPCs空白组(NSCs+EPCs moxibustion group vs NSCs+EPCs control group in the same therapy)
VD模型组(model) N+E空白组(N+E control) N+E艾灸组(N+E moxibustion)
注:(×400,DAPI:蓝色,Nestin/EGFP:黄色,黄色箭头:阳性表达)
Notes:(×400,DAPI:blue,Nestin/EGFP:yellow,Yellow arrow:positive expression)
图5 Nestin/EGFP免疫荧光双标表达图
Fig5 Nestin/EGFP expression in immunofluorescent staining pictures
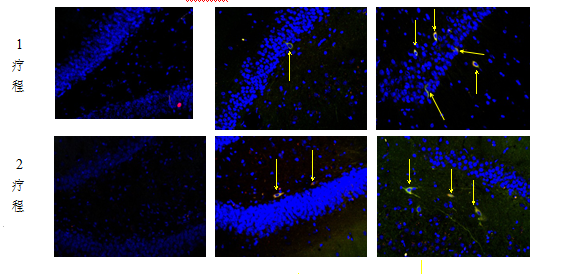

2.2.2 DCX
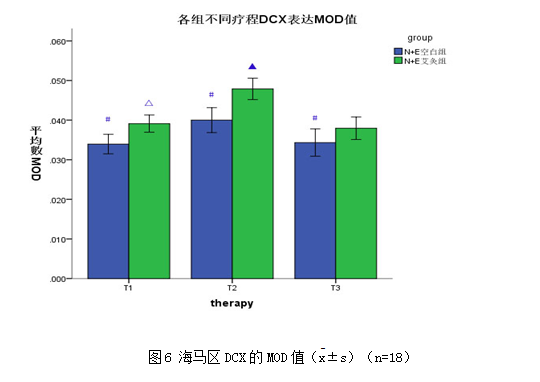
NSCs+EPCs艾灸组在治疗2疗程后,大鼠海马区DCX表达较1疗程后增多(P<0.05),3疗程后表达较2疗程后减少(P<0.05),但与NSCs+EPCs空白组比较,各平行疗程后DCX的表达并无明显差异(P>0.05),见图6、图7。说明DCX在细胞移植后开始表达,第2疗程表达最多,以后逐渐减少。

VD模型组(model) N+E空白组(N+E control) N+E艾灸组(N+E moxibustion)
注:(×400,DAPI:蓝色,DCX/EGFP:黄色,黄色箭头:阳性表达)
Notes:(×400,DAPI:blue,DCX/EGFP:yellow,Yellow arrow:positive expression)
图7 DCX/EGFP免疫荧光双标表达图
Fig7 DCX/EGFP expression in immunofluorescent staining pictures
3 讨论
传统的中医理论常把VD划为呆病,表现为意识、思维、情志等精神活动的异常。脑主司精神活动,作为奇恒之腑,内藏之脑髓是脑功能正常发挥的物质基础,故髓海空虚、脑髓失养是痴呆发病的主要病理机制,而瘀血阻络,脑络不通是导致脑髓失养的常见原因,故血瘀与VD的发病关系密切。化瘀通络灸法取督脉穴百会、大椎、神庭,压灸百会,悬灸大椎、神庭,把艾灸的温经通络、消瘀散结作用与腧穴的特异性作用结合,“通经络、化瘀血、填髓海、醒神志”,研究表明可改善血液循环、激活脑组织代谢,进而促进海马与额、顶叶之间神经功能网络连接[15、16]调节各种神经信号通路[17]减缓痴呆的发展[18],对大脑认知功能有一定的改善[19]。
在VD的发病过程中,大脑皮质、下丘脑、海马和纹状体等部位的神经活动和神经递质水平明显下降[20],其中海马CA1区椎体细胞功能尤与学习、记忆关系密切,是保证记忆功能正常发挥的重要区域[21、22],其锥体细胞的丢失对VD记忆障碍,特别是记忆的编码、存储、提取障碍的发生尤为重要[23、24],这进一步说明,海马神经细胞损伤可能影响记忆的形成和延迟回忆的产生,进而导致痴呆的发生。近年来神经科学研究发现,诱导海马神经新生可在一定程度上改善VD大鼠记忆,增强其学习能力。针刺被证实可促使脑缺血大鼠海马、SVZ区Nestin、DCX表达增强。Nestin的出现说明NSCs开始增殖,其大量表达表明NSCs处于增殖的旺盛阶段[25、26],DCX[27]则集中表达在分化、移行的神经元前体细胞中,这又进一步表明针刺可以促进NSCs增殖、迁移[2-7],并向神经元细胞分化[8],即促进神经新生。血管新生与神经新生之间又存在密切的关系[28、29],前期大量研究表明,化瘀通络灸可促进VD大鼠脑损伤要害部位的血管生成[9],但针刺和艾灸对机体的调节可能是通过不同的传导通路实现的[10]。根据神经新生和血管新生之间存在密切关系这一观点,我们推测化瘀通络灸可能促进脑内神经新生,而这一过程可能是通过促进脑内NSCs增殖、迁移、分化、成熟实现的。
综合本实验研究结果,我们发现VD模型复制后,大鼠的延迟回忆成绩下降;镜下观察脑组织切片,均未发现Nestin、DCX阳性细胞。说明虽然理论上脑缺血后的应激反应可以激活NSCs,促进其增殖、迁移、分化,进而在一定程度上参与受损神经功能的修复,但这种单纯缺血缺氧损伤诱导的神经新生无论是在数量上还是时间上都非常有限,难以代偿损伤的脑组织。
NSCs+EPCs侧脑室移植后,VD大鼠的延迟回忆成绩提高,但疗效不及NSCs+EPCs化瘀通络灸治疗组;海马区Nestin、DCX表达增强,虽然2种蛋白的表达量随治疗时间延长呈现不同的变化趋势,但NSCs+EPCs化瘀通络灸治疗组疗效优于平行疗程的NSCs+EPCs空白组。结合前期研究报道我们分析原因可能为虽然NSCs+EPCs移植可以模拟缺血性脑损伤的修复中神经生成与血管生成相互促进生长的微环境,即神经血管小生境[30、31],但脑内缺血缺氧的状态使这个微环境难以维持,移植的细胞并不能很好的增殖、迁移、分化进而发生作用[32]。
结合实验结果我们进一步推测,对VD大鼠NSCs+EPCs移植后使用化瘀通络灸进行治疗,可促使其海马区Nestin、DCX表达增强,即促进NSCs的增殖、迁移、分化,进而促进神经新生,从而更好地提高VD大鼠的延迟回忆水平,这也为以后临床治疗VD提供了新的理论依据。
参考文献
[1]贾建平,崔丽英,王伟,等. 神经病学[M]. 北京:人民卫生出版社,2008,6:205.
[2]繆化春,吴锋,丁见,等. 电针联合天麻多糖对脑缺血大鼠齿状回神经干细胞巢蛋白和干细胞因子表达的影响[J]. 针刺研究,2014,39(1):40-45.
[3]胡丙成,徐莺莺,张静,等. 艾灸对脑缺血后内源性干细胞的增殖影响的实验研究[J]. 上海针灸杂志,2016,35(5):600-607.
[4]罗丁,樊小农,赵海英,等. 针刺人中穴对MCAO大鼠中枢神经系统神经干细胞增殖影响的研究[J]. 天津中医药,2014,31(9):548-551.
[5]乐薇,刘银妮,王琼,等. 头针对脑缺血再灌注大鼠神经干细胞增殖分化干预效果的实验研究[J]. 湖北中医药大学学报,2013,15(2):12-15.
[6]韩永升,韩咏竹,徐磊. 电针对局灶性脑缺血再灌注大鼠神经生长相关蛋白GAP-43和Nogo-A表达的影响[J]. 中国康复理论与实践,2013,19(2):119-123.
[7]肖爱娇,罗小泉. 艾灸对脑缺血再灌注损伤模型大鼠大脑皮质NF-kB p65蛋白表达的影响[J]. 中华中医药杂志,2013,28(12):3532-3535.
[8]王少帅,李常新,尤洪岭,等. 大鼠脑梗死后神经前体细胞移行及电针作用的研究[J]. 中西医结合心脑血管病杂志,2012,3(10),333-335.
[9]王频,汤敬一,杨骏. 艾灸对血管性痴呆大鼠海马内VEGF、flt-1、bFGF及bFGF-r表达的影响[J]. 中国中西医结合杂志,2012,32(1):97-101.
[10]唐勇,乔秀兰,尹海燕,等. 针灸对SAMP8小鼠嗅球神经干细胞增殖分化的影响[J]. 生物医学工程学杂志,2009,26(6):1295-1299.
[11]张全鹏,王慧,陈旦,等. 水合氯醛、乌拉坦及其1:1混合液在SD大鼠麻醉中的效果比较及应用[J]. 现代生物医学进展,2011,21(7):1208-1212.
[12]Yu J,Liu C,Zhang X,et al. Acupuncture improved cognitive impairment caused by multi-infarct dementia in rats[J]. Physiol Behav,2005,86(4):434-441.
[13]谢艳萍,朱晓峰.共移植体对神经干细胞向神经元分化的影响[J].黑龙江医药科学,2007,30(3):3-4.
[14]Paxinos G,Wat son C. The rat brain in stereotaxic coordinates [M]. 6th ed. New York : Academic Press Inc,2007.
[15]张迪,邓俏,孙阳.电针百会、风府穴对学习记忆障碍大鼠Bcl-2/Bax基因表达的影响[J]. 中医药信息,2013,30(1):73-75.
[16]林志诚,杨珊莉,薛偕华,等. 针刺百会穴改善脑卒中患者记忆力的中枢机制[J]. 中国康复理论与实践,2015,21(2):184-188.
[17]刘娇,冯晓东.电针百会、神庭穴配合康复训练治疗脑卒中后认知障碍临床研究[J]. 中医学报,2013,28(4):608-610.
[18]张宏,郇玉红. 针刺督脉三穴治疗脑动脉硬化性痴呆疗效分析[J]. 四川中医,2008,26(1):116-117.
[19]朱永磊,黄川,邢甲进. “从督论治”针刺法治疗脑卒中后认知功能障碍40例[J]. 安徽中医药大学学报,2014,33(2):50-52.
[20]Pimlott SL,Piggott M,Owens J,et a1. Nicotinic acetylcholine receptor distribution in Alzheimer′s disease,dementia with Lewy bodies,Parkinson′s disease,and vascular dementia: in vitro binding study using 5-[HT]-a-85380[J]. Neuropsychopharmacology,2004,29:108-116.
[21]林鸿,季迁,李敏. 海马损伤对大鼠学习和记忆的影响[J]. 中国临床康复,2002,6(13): 1912-1913.
[22]刘朝阵,陈景藻,谭永霞,等. 8Hz 90dB次声对大鼠海马细胞内钙离子及内质网钙通道蛋白RyRs表达的影响[J]. 第四军医大学学报,2005,26(2):185-188.
[23]高东,王景周,姚国恩,等. 海马及皮层神经元的丢失与血管性痴呆发病机制的实验研究[J]. 中国行为医学科学,2002,11(3):252-254.
[24]虞猛,徐丽红,段英俊,等. 不同部位脑出血恢复期记忆损害特点的临床研究[J]. 中外医疗,2016,34:1-3+10.
[25]张业贵,龚鑫,李怀斌. 电针对脑缺血再灌注大鼠齿状回Nestin、GFAP表达的影响[J]. 中国组织化学与细胞化学杂志,2015,23(2):148-153.
[26]朱旅聪,刘学红,张泳,等. TRAIL、MAP-2和Nestin在流产患者绒毛组织中的表达及意义[J]. 现代医药卫生,2015,31(17):2569-2571.
[27]付学军,黄巧英,徐铅辉,等. 持续脑缺血后半暗带区星形胶质细胞的转归[J]. 华中科技大学学报:医学版,2014,43(5):532-536.
[28]Sun J. Endothelial cells promote neural stem cell proliferation and differentiation associated with VEGF activated Notch and Pten signaling[J]. Dev Dyn,2010,239(9):2345-2353.
[29]Bao X. Transplantation of human bone marrow-derived mesenchymal cells promotes behavioral recovery and endogenous neurogenesis after cerebral ischemia in rats[J]. Brain Res,2011,136(7):103-113.
[30]Madri JA. Modeling the neurovascular niche:implications for recovery from CNS injury[J]. J Physiol Pharmacol,2009,60(4):95-104.
[31]Fuchs E,Tumbar T,Guasch G. Socializing with the neighbors:stem cells and their niche[J]. Cell,2004,116(6):769-78.
[32]Charles VV,Michael TW. Morris water maze:procedures for assessing spatial and related forms of learning and memory[ J]. Nature Protocols,2006,1(2):848-858.

 世界针灸学会联合会
世界针灸学会联合会