基于核磁共振氢谱(1H NMR)技术研究电针“内关”穴对心肌缺血再灌注损伤大鼠心肌组织代谢物的影响
唐雅妮1,谭成富1,刘薇薇1,王 超1,杜 琳1,陈美琳1,李姣兰1,朱鼎铭1
(1湖南中医药大学针灸推拿学院,湖南长沙410007)
摘要: 研究目的:基于核磁共振氢谱(1H NMR)技术研究电针“内关”穴对心肌缺血再灌注损伤(MIRI)大鼠心肌组织代谢物的影响,拟阐明电针“内关”穴对MIRI大鼠代谢模式的影响。研究方法:30只SD雄性大鼠随机分为对照组(n=10)、模型组(n=10)、电针组(n=10)。对照组:不予电针,仅用鼠板束缚大鼠,每次20 min,每日一次,持续7d;模型组:同对照组,至第7d后行心肌缺血再灌注造模;电针组:术前每日电针双侧“内关”穴一次,时间20 min,于第7d后,造模。收集大鼠的心肌组织。采用1H NMR技术获取大鼠心肌组织的1H NMR谱,利用模式识别方法来分析各组代谢物的变化及各组间代谢模式的区别。研究结果:与对照组相比,模型组大鼠心肌组织的乳酸、丙氨酸、赖氨酸、谷氨酸、谷氨酰胺、天冬氨酸、甘油磷酸胆碱、肌酸、牛磺酸、甘氨酸、 苏氨酸、腺苷一磷酸、烟酰胺腺嘌呤二核苷酸浓度下降,葡萄糖浓度明显上升;与模型组相比,电针组心肌组织琥珀酸、肌酸、甘油磷酸胆碱、烟酰胺腺嘌呤二核苷酸浓度上升,葡萄糖、苏氨酸、腺苷一磷酸浓度下降,与模型组心肌组织代谢模式比较接近,有向对照组偏移的趋势,但与对照组差异还是较大。结论:电针“内关”穴可调节MIRI大鼠糖代谢、脂代谢、氨基酸代谢及能量代谢,对心肌具有一定的保护作用,但其具体的代谢通路及机制需要进一步研究。
关键词:电针;核磁共振;心肌缺血再灌注损伤;代谢组学
Study on the Effects of Electroacupuncture at “Neiguan”(PC 6) on Rats with Myocardial Ischemia Reperfusion Injury on Myocardial Tissue Metabolites Based on 1H NMR
TANG Ya-ni1, TAN Cheng-fu1, LIU Wei-wei1,WANG Chao1, DU Lin1, CHEN Mei-lin1, LI Jiao-lan1, ZHU Ding-ming1
(1 College of Acupuncture and Moxibustion of Hunan University of Chinese Medicine, Changsha 410007, China)
Abstract: Objective To study the effects of electroacupuncture at “Neiguan”(PC 6) point on myocardial ischemia reperfusion injury (MIRI) rats in metabolites of myocardial tissue based on 1H nuclear magnetic resonance (1H NMR) technology. And to clarify its effects on the metabolic pattern of MIRI rats. Methods: 30 male SD rats were randomly divided into blank control group (n=10), model group (n=10) and electroacupuncture group (n=10). Control group: no electroacupuncture, only banded by rat board, 20min each time, once a day for 7 days. Ischemia reperfusion model group: do the same thing until the seventh day and then form the myocardial ischemia reperfusion model; Electroacupuncture group: To electroacupuncture bilateral “Neiguan”(PC 6) point daily, 20min each time, and form the myocardial ischemia reperfusion model on the seventh day. Than myocardial tissues of rats were collected. The 1H NMR spectroscopy was determined with the 1H NMR technique. The change of metabolites in each group and the difference of metabolic patterns among each groups were analyzed by pattern recognition method. Results: Compared with the control group, myocardium lactate, alanine, lysine, glutamate, glutamine,aspartate,GPC, creatine,
taurine,glycine,threonine,adenosine monophosphate (AMP),nicotinamide adenine dinucleotide (NAD+) concent in model group decreased,while glucose increased. Compared with the model group, myocardium succinate, creatine,GPC and NAD+ content in “Neiguan”(PC 6) group increased, while glucose, threonine and AMP decreased. The pattern of myocardial tissue metabolism of “Neiguan” (PC 6) group were similar to model group, and it has a trend to the control group. But the significant difference between the “Neiguan” (PC 6) group and the control group still exist. Conclusion: Electroacupuncture at Neiguan can regulate glucose metabolism, lipid metabolism, amino acid metabolism and energy metabolism in MIRI rats, and have a protective effect on myocardium, but its specific metabolic pathway and mechanism need to be further studied.
Key Words: Electroacupuncture, Nuclear magnetic resonance, Myocardial ischemia reperfusion injury, Metabonomics
针灸已有三千年多年的历史,因其疗效显著,适应症广泛,在世界范围内得到了越来越多的认可[1-4],针灸的现代研究也逐步地由微观水平向宏观转变。由于近年来引入了一些新技术,尤其是代谢组学技术的应用,使现代研究技术与中医针灸的“整体观”和“治未病”特色形成了新的契合点,这对于揭示针灸的作用机制有着重要的意义[5-9]。
冠心病作为最常见的心血管疾病,已严重影响人类的健康。代谢组学强调把人或动物作为一个整体来研究,把研究对象看作一个整体的全局观念与中医的“整体观”不谋而合;并且代谢组学强调用动态观点来研究生物体, 这又与中医的辨证论治的“动态观”又有异曲同工之处。针灸是在中医理论的指导下发展而来,更注重“整体观”,针灸对机体的作用是多靶点、多层次、多途径、多系统的,并引起全身性的代谢变化,与代谢组学研究模式颇为相似,因此代谢组学技术可能为阐释针灸效应规律和生物学基础提供新的契机。心血管病大多发病隐蔽,早期诊断困难,发病机制尚不明确,代谢组学可以从代谢网络的角度进一步阐述缺血性心肌代谢的整体变化,寻求心肌缺血与针刺效应的特征性代谢物。鉴于代谢组学技术的诸多优势,目前已被广泛的应用于中医药领域[10-16]。
本文借助核磁共振(NMR)波谱技术研究MIRI大鼠心肌组织内源性代谢物,寻找心肌缺血再灌注的特异性代谢标记物及其代谢途径,探究电针“内关”穴对MIRI大鼠的预保护效应,并借此阐明电针“内关”穴对MIRI大鼠的代谢调控网络及分子机制,从而揭示心包经与心相关的代谢物质基础。
1 材料与方法
1.1 实验动物及分组处理
由湖南中医药大学动物实验中心提供健康SPF级SD大鼠30只,雄性,体质量250~350g(动物许可证号:SYXK(湘)2013-0005)。于湖南中医药大学实验室中饲养,提供充足的饮用水与标准饲料,温度保持在20至22℃,相对湿度控制在65%至70%,在自然光暗周期内进行适应性饲养1周后再进行实验。
按随机数字表法将大鼠分为3组,对照组、模型组、电针组,每组10只。对照组:不予电针,仅用鼠板束缚大鼠,每次20 min,每日一次,持续7d;模型组:同对照组,至第7d后行心肌缺血再灌注造模。开胸,左冠状动脉前降支根部穿线结扎40 min后,松扎再灌注60 min;电针组:术前每日电针双侧“内关”穴一次,时间20min。于第7d后,开胸,左冠状动脉前降支根部穿线,结扎40 min,再灌注60 min。实验中对动物的处理符合中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》。
1.2 主要仪器与试剂
汉医牌一次性使用无菌针灸针(0.25mm×13mm,100支/盒,长春爱泉医疗器械有限公司);华佗牌SDZ-V型电子针疗仪(苏州医疗用品有限公司);动物呼吸机ALC-V 108(上海奥尔科特生物科技有限公司);数字式六道心电图机ECG-1106 G(深圳市凯沃尔电子有限公司);医用离心机台式高速离心机H1850动(湖南湘仪实验室仪器开发有限公司);组织匀浆机(Biospec Products Inc., USA);核磁共振谱仪Bruker Avance III 600MHz(Bruker, Germany);氮吹仪(杭州奥盛仪器有限公司);GRANT制冰机(上海民仪电子有限公司);水合氯醛、4%多聚甲醛(上海山浦化工有限公司);0. 9% 氯化钠注射液(武汉市滨湖双鹤药业有限公司);氯仿(国药集团化学试剂有限公司);D2O(99.9%氘代,Sigma, USA);TSP(Cambridge Isotope Laboratories, USA)。数据分析软件:MestReNova Version 6.1(Mestrelab Research S.L., Espain),MATLAB2011b (Math Works, USA),SIMCA-P Version12.0 (Umetrics AB, Umeå, Sweden)
1.3 造模方法
缺血/再灌注造模(I/R):大鼠腹腔注射10%水合氯醛(0.3 mL/100 g)作全身麻醉,仰位固定在鼠台上。行术前心电图(将电极刺于大鼠皮下,标准电压20 mm/mV,走纸速度为25 mm/s),心电图异常或不符合标准的剔除出组。颈部去毛,行气管切开术,接动物人工呼吸机(呼吸频率70次/min ,呼吸比1∶2,潮气量约2-3 mL/100 g),沿胸骨正中线左侧旁开0.5-1 cm处切开皮肤,暴露肋骨,从第三、四肋间隙处开胸,暴露心脏,用弯止血钳将心包膜前部挑开,然后用无齿镊将左心耳轻轻提起,以左冠状动脉主干为标志,再用持针器持无创性小圆弯针在左冠状动脉前降支上、中1/3交界处穿一根零号医用缝合线,在穿线处置一硅胶管结扎血管,立即心电图监测。关闭胸腔,结扎40 min后开胸,松开硅胶管,恢复左前降支灌流60 min。
动物造模成功标准[17]:1)心肌缺血成模标准:结扎下段血管膨出发绀、左室前壁发绀及心电图II导联ST段抬高伴T波高耸。2)再灌注成模标准:松扎血管下段供血心肌颜色由发绀变浅或转为暗红色及T波下降超过0.2 mv。
具有下列情况之一者退出实验:①术中出血过多;②在稳定过程中,动物出现较严重的心律失常;③结扎冠状动脉失败或未发生再灌注;④呼吸心跳停止超过30 s者;⑤出现自发性室颤,60 s内不能自行转复者。
1.4 电针方法与穴位定位
电针组取双侧“内关”穴,直刺入穴位约3 mm,行提插捻转手法(平补平泻)1 min 后接电针(穴位接负极,正极接大鼠尾部)。电针参数:疏密波,频率10 Hz/50 Hz,脉冲宽度0.5 ms,强度1 mA,以上肢轻微颤动为度,时间20 min,1次/d,共电针7 d。“内关”穴定位参照李忠仁[18]主编的《实验针灸学》。“内关”:前肢内侧、离腕关节约3 mm左右的尺桡骨缝间。均取双侧穴位进行针刺。
1.5 标本的采集与处理
心肌组织的采集:摘取心脏,置于冰冷的0.9%的氯化钠注射液中冲洗,除去血液,滤纸拭干,取结扎下方左心室心肌部分组织0.3 g用冰冷的0.9%的氯化钠注射液清洗干净(主要是组织上附带的血液和其他黏膜等)。洗净的心肌组织快速转入-80℃冰箱保存。将心肌组织各100 mg绞碎,匀浆,取50 μL,放入匀浆瓶中,依次加入200 μL甲醇和65 μL去离子水后,用匀浆机于0℃下匀浆30 s。再向匀浆瓶依次加入200 μL氯仿和200 μL去离子水后,混匀器混匀60 s,于冰上静置分离10 min。将混合液移至1.8 mL的玻璃离心管中,在4℃下以5 000 r/min转速离心5 min。分别取出上、下层清液,转移入2个洁净的离心管中,上层先用氮吹仪吹干大部分甲醇,再在-80℃冰箱冷冻3 h后,置于冻干机冷冻干燥24 h以除去残余的甲醇、水和氯仿溶剂。实验时加入550 μL 磷酸盐缓冲液(含D2O和TSP)并移入5 mm NMR管,在Bruker Avance III 600 MHz谱仪上进行心肌组织的核磁共振检测。
1.6指标检测
采用核磁共振波谱技术,样品预处理:组织萃取物干粉中加入550 μL磷酸盐缓冲液,使样品溶液pH值稳定在7.4;混合均匀后,以12 000 r/min高速离心5 min,取上清移入5 mm NMR管。
实验序列和脉冲参数:本实验采用的脉冲序列为noesypr1d [RD-90°-t1-90°-tm-90°-acq](Bruker Biospin pulse program library)。水峰压制作用在弛豫等待时间内,谱图的采样数据(TD)点为64K,谱宽(SW)为12k Hz,累加次数(NS)为32次,空采次数(DS)为4次。
1.7数据分析处理
谱图数据预处理:对所有谱图进行信号去噪、基线和相位校正,然后对数据分段积分、行、列归一化以及尺度标准化处理。所有数据预处理均由MestReNova软件(Version: 6.1 Mestrelab Research S.L.)和MATLAB2011b(MathWorks, USA)处理完成。
模式识别分析:采用非监督模式识别的主成分分析(PCA)法和监督性模式识别方法,如偏最小二乘分析(PLS-DA)、正交偏最小二乘分析(OPLS-DA)进行模式识别。所有的模式识别分析均在SIMCA-P软件(version 12.0, Umetrics AB, Umeå, Sweden)上完成。
1.8统计学方法
将所有图谱数据输入到SIMCA-P 12.0 软件中进行主成分分析(Principalcomponents analysis, PCA)。为了消除相关因素如个体差异等对分组的影响,强化组间差异,进一步采用正交信号校正(Orthogonal Signal Correction,OSC)处理,再进行偏最小二乘法判别分析(Partial Least Squares Discriminant Analysis,PLS-DA),即O-PLS-DA。结果以得分图(Scores Plot)和载荷图(Loadings Plot)体现。
2 结 果
2.1 心肌组织的1H NMR谱
图1为对照组、模型组、电针组三组心肌组织样品中检测的1H NMR谱。图中标出了一些常见的代谢物葡萄糖(glucose)、乳酸(lactate)、丙氨酸(alanine)、赖氨酸(lysine)、谷氨酸(glutamate)、谷氨酰胺(glutamine)、天冬氨酸(aspartate)、肌酸(creatine)、牛磺酸(taurine)、甘氨酸(glycine)、 苏氨酸(threonine)、腺苷一磷酸(AMP )、甘油磷酸胆碱(GPC)、烟酰胺腺嘌呤二核苷酸(NAD+)等。
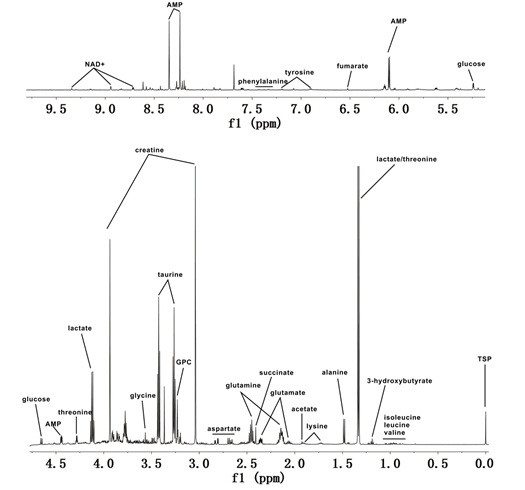
图1 心肌组织样品的典型1H-NMR谱
2.2 代谢模式的变化
主成分分析法(Principle Components Analysis, PCA)被用来分析SD大鼠心肌组织样品,得分图中的每一个点代表一个样本的1H-NMR图谱,观察样品聚集、离散及离群点。为了找出3组SD大鼠心肌组织代谢物的差异,观察3组SD大鼠心肌组织的代谢模式是否有区别,我们采用PCA方法对心肌组织样品的数据矩阵进行统计分析,PC1-PC2-PC3代表数据矩形阵中最显著的特性,一般PC1包含了数据的绝大部分方差,其数值越大表示其提取的原有信息越多。
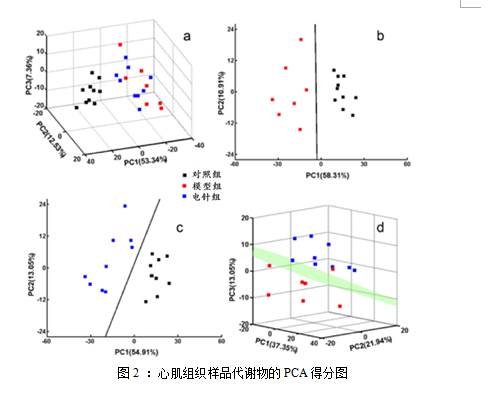
注:图2a:所有组样本(10只大鼠/组);图2b:对照组与模型组;图2c:对照组与电针组;图2d:模型组与电针组
2.3 特征代谢物及其变化
为进一步找出组间的差异,我们使用正交偏最小二乘分析(Orthogonal partial least squares-discriminant analysis, OPLS-DA)进行分析。在OPLS-DA之前,先使用偏最小二乘分析(Partial least squares-discriminant analysis, PLS-DA)进行模型的验证。Q2的意义和线性回归分析中的决定系数 R2相似,R2反映的是模型的拟合效果,Q2反映的是模型的预测能力。Q2的取值可以是负值( -∞< Q2≤1) ,其值越接近1说明模型的预测效果越好,如果其值为负值则表示预测能力差或完全没有预测能力。
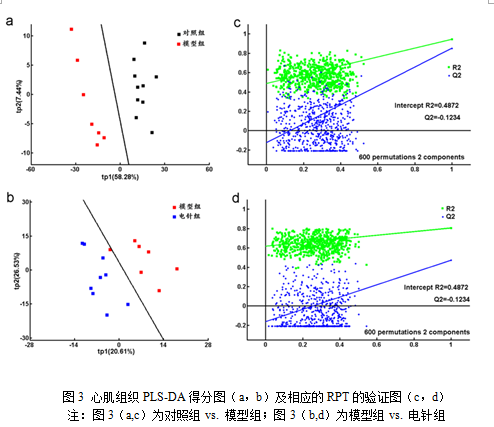
图3为PLS-DA得分图及对应的RPT的验证图,对心肌组织的数据进行PLS-DA分析,并进行置换排序实验(RPT)验证模型的可靠性。从图3a可见对照组与模型组能明显的区分,图3b可见模型组与电针组未能明显区分,模型组和电针组心肌组织之间的代谢模式差别相对较小。从图3c、3d对应的RPT验证图中可见回归线斜率较大,没有过拟合,且Q2>0,表明PLS-DA模型质量较高,预测效果较好,模型可靠。
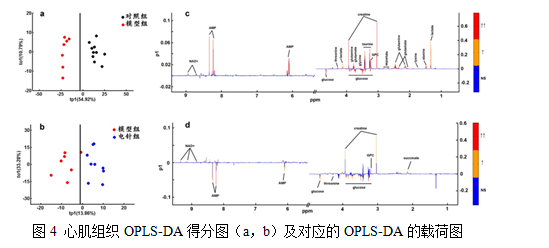
注:图4(a,c)为对照组vs.模型组;图4(b,d)为模型组vs.电针组;红色表示代谢物显著性(VIP)高,橙色表示较高,而蓝色表示没有显著性。
从图4a可见对照组和模型组之间的样品点沿中线分开,图4b可见模型组和电针组之间的样品点无法沿中线分开,表明对照组和模型组之间有一定的差异,模型组与电针组的差异不大。图4c横坐标表示化学位移,纵坐标内的正值区间表示该区间内代谢物在对照组的浓度偏高,纵坐标内的负值区间表示该区间代谢物在模型组的浓度偏高,见表1;图4d横坐标表示化学位移,纵坐标内的正值区间表示该区间内代谢物在模型组的浓度偏高,纵坐标内的负值区间表示该区间代谢物在电针组的浓度偏高,见表2。
根据图4,找出两组对比的特征性代谢物(表1,表2)。
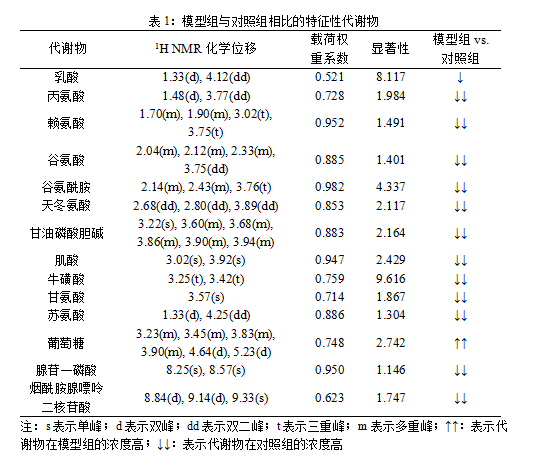
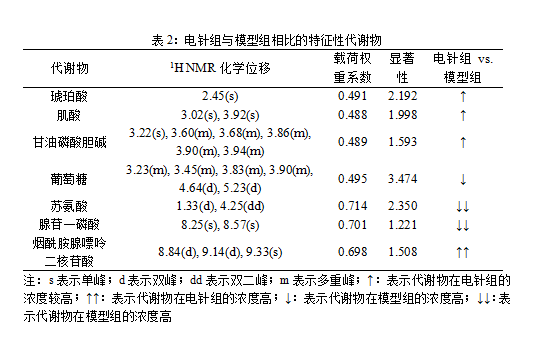
从表1、表2可见,与对照组相比,MIRI模型组大鼠心肌组织的乳酸、丙氨酸、赖氨酸、谷氨酸、谷氨酰胺、天冬氨酸、甘油磷酸胆碱、肌酸、牛磺酸、甘氨酸、 苏氨酸、腺苷一磷酸、烟酰胺腺嘌呤二核苷酸浓度下降,葡萄糖浓度明显上升。经电针“内关”穴后MIRI大鼠心肌组织的琥珀酸、肌酸、甘油磷酸胆碱、烟酰胺腺嘌呤二核苷酸浓度上升,葡萄糖、苏氨酸、腺苷一磷酸浓度下降。
3 讨 论
早期已经做了大量针刺“内关”穴对心肌缺血再灌注损伤的保护及其机理的动物实验研究[19-29]。心肌缺血是临床上常见的症状,心脏泵血需要消耗能量,心肌在正常有氧的情况下,所需要的能量主要依靠游离脂肪酸和碳水化合物提供,当心肌发生缺血时,机体内的糖代谢、脂质代谢、氨基酸代谢、能量代谢均会发生紊乱,而代谢紊乱产生的过程是缺血性心脏病的关键病理环节之一。代谢组学技术从代谢的角度进一步揭示心肌缺血时心肌的病理生理变化,从生物信息学的方面分析生物标志物的变化,有助于为缺血性心脏病提供新的治疗靶点。
MIRI大鼠心肌组织的葡萄糖浓度明显上升,心肌缺血后机体由于缺氧处于无氧糖酵解的应急代谢状态,对葡萄糖的跨膜转运是调控心肌葡萄糖代谢的一种方式[30]。经电针“内关”后,葡萄糖、苏氨酸、腺苷一磷酸浓度下降,心肌经过短暂的缺血再灌注后,减少对葡萄糖的利用,说明电针“内关”后可以保护缺血心肌和改善再灌注后心肌功能的恢复。苏氨酸作为必需的氨基酸,具有特有的脱氨基作用,可以释放大量的自由能,其浓度下降,可能与糖酵解的增强有关。腺苷一磷酸是三磷酸腺苷(ATP)合成的基础,ATP是心肌收缩能量的直接形式,腺苷一磷酸减少直接影响着ATP的合成及其在心肌细胞内的含量,ATP的缺乏使Na+/K+-ATP酶活性受抑制,细胞内的Na+的浓度不能及时排出,Na+浓度升高启动Na+-Ca2+交换,从而使线粒体Ca2+增多,使细胞内呼吸链功能受损,ATP进一步减少形成恶性循环,加速心肌细胞的死亡[31-32],故电针“内关”后腺苷一磷酸的浓度仍呈下降趋势,表明心肌的能量合成受到障碍,这与文献报道心肌缺血时血清中ATP、一磷酸腺苷、腺苷浓度显著降低一致[33]。
本文借助于核磁共振的代谢组学方法观察电针“内关”对MIRI模型大鼠心肌组织的代谢产物的变化规律及代谢模式的影响,进一步揭示了MIRI的损伤和修复代谢机制以及心包经与心相关的科学内涵,也印证了中医理论,“心包代君受邪”的理论。同时从生物学角度阐释了针灸的整体作用机制,具有重要的研究意义,揭示了电针“内关”穴对MIRI大鼠对心肌具有潜在的保护作用,但其具体的代谢通路及机制需要进一步研究。
参考文献
[1] YU JS, ZENG BY, HSIEH CL. Acupuncture stimulation and neuroendocrine regulation[J]. Int Rev Neurobiol , 2013, 111(111):125-132.
[2] LU Z, DONG H, WANG Q, et al. Perioperative acupuncture modulation: more than naesthesia[J]. Bja Br J Anaesth, 2015, 115(2):183-193.
[3] YANG Y, LIU Y. BO's abdominal acupuncture for obese type-2 diabetes mellitus[J]. Zhongguo zhen jiu , 2015, 35(4):330-334.
[4] 钟欢, 佘畅, 呙安林,等. 基于1H-NMR技术探讨艾灸与针刺对血清代谢物的调节作用[J]. 世界科学技术-中医药现代化, 2016, 18(3):402-409.
[5] 陈勤, 吴巧凤, 方剑乔. 代谢组学技术在针灸作用机制研究中的进展及展望[J]. 浙江中医药大学学报, 2016, 40(3):223-226.
[6] 杜小正,袁博,张星华,等. 基于代谢组学研究热补针法治疗类风湿关节炎寒证家兔的作用机制[J]. 针刺研究,2017,42(03):202-208,216.
[7] 高骏, 刘旭光, 颜贤忠,等. 代谢组学研究针灸关键问题的初步策略分析与探讨[J]. 针刺研究, 2011, 36(4):296-301.
[8] 赵珊, 王鹏程, 冯健,等. 代谢组学技术及其在中医药研究中的应用[J]. 中草药, 2015,46(5):756-765.
[9] 吴巧凤, 毛森, 蔡玮,等. 针刺俞、募穴对功能性消化不良大鼠血清大分子代谢产物的影响[J]. 针刺研究, 2010, 35(4):287-292.
[10] 陈婷, 朱永康. 代谢组学在中医药领域中研究与应用[J]. 辽宁中医药大学学报,
2015,17(5):184-187.
[11] 李先娜, 董辉, 孙晖. 代谢组学在中医药现代化研究中的应用[J]. 中医药信息, 2016, 33(5):114-117.
[12] 邓淑芳, 吴巧凤, 杨明晓,等. 代谢组学技术及其在针灸关键科学问题研究中的应用[J]. 世界中医药, 2015,10(4):472-476.
[13] 马婷婷, 刘迈兰, 梁繁荣. 系统生物学与针灸现代化[J].针刺研究,2008,33(6):413-415.
[14] GU J, HU X, SHAO W, et al. Metabolomic analysis reveals altered metabolic pathways in a rat model of gastric carcinogenesis[J]. Oncotarget, 2016, 7(37):60053-60073.
[20] 王娟, 李中峰, 赵慧辉, 陈建新, 陈婵, 柴欣楼, 王伟.冠心病不稳定心绞痛血瘀证患者尿液代谢组学
特征的研究[J].北京中医药大学学报.2012,35(4);284-288
[15] YAN B, DENG Y, HOU J, et al. UHPLC-LTQ-Orbitrap MS combined with spike-in method for plasma metabonomics analysis of acute myocardial ischemia rats and pretreatment effect of Danqi Tongmai tablet[J]. Mol Biosyst, 2015, 11(2):486-496.
[16] ZOU H M, ZHANG B, XU X C, et al. Urinary metabolomic strategy to evaluate Compound Danshen Dripping Pills for myocardial ischaemia in rats[J]. J Pharma Biomed Anal, 2015, 11(2):98-105.
[17] 王砚青, 江时森, 刘平,等. 大鼠心肌缺血-再灌注模型心电图变化分析[J]. 医学研究生学报, 2006, 19(8):700-702.
[18] 李忠仁.实验针灸学[M].第2版,北京:中国中医药出版社,2007,255-257.
[19] 严洁, 杨孝芳, 易受乡,等. 电针“内关”对心肌缺血再灌注损伤大鼠心肌细胞膜钠泵活性及其基因表达的影响[J]. 针刺研究, 2007, 32(5):296-300.
[20] 严洁, 刁利红, 易受乡,等. 电针内关穴对心肌缺血再灌注损伤大鼠心肌能量代谢及组织形态学的影响[J]. 中国组织工程研究, 2007, 11(47):9443-9447.
[21] 王超, 谢文娟, 刘密,等. 针灸预处理对不同时间心肌缺血再灌注损伤兔血浆内皮素、血清肌酸激酶和心肌组织热休克蛋白70表达的影响[J]. 针刺研究, 2014, 39(5):372-376.
[22] 王超, 张佳丽, 刘昭,等. 电针内关穴预处理对兔心肌缺血再灌注 CK 及心肌细胞活性的影响[J]. 上海针灸杂志, 2015,34(1):67-69.
[23] 林海波, 严洁, 常小荣,等. 针灸内关穴预处理对兔缺血再灌注损伤心肌细胞死亡受体通路Fas/FasL蛋白表达的影响[J]. 中华中医药杂志, 2013,28(5):1286-1290.
[24] 王超, 田岳凤, 周丹,等. 电针“内关”穴对心肌缺血再灌注大鼠心肌组织一氧化氮、一氧化氮合酶和细胞内钙的影响[J]. 针刺研究, 2010, 35(2):113-117.
[25] 成泽东, 陈以国, 李晓梅,等. 电针“内关”穴对急性心肌缺血小鼠心肌组织氯离子通道蛋白表达的影响[J]. 针刺研究, 2016, 41(5):423-428.
[26] 白增华, 吴兆利, 苏妆,等. 电针“内关”穴对心肌缺血大鼠心肌氯离子通道相关基因表达的影响[J]. 针刺研究, 2015, 40(6):439-443.
[27]张江玲, 陈杰, 王祥瑞,等. 电针“内关”穴预处理对缺血再灌注大鼠心肌的保护作用[J]. 针刺研究, 2010, 35(3):182-187.
[28] 谭成富, 严洁, 王超,等. 针灸预处理对心肌缺血再灌注损伤兔不同时间热休克蛋白27、70、90表达的影响[J]. 针刺研究, 2017, 42(1):31-38.
[29] 宋瑾, 王超, 阳仁达,等. 电针内关穴预处理对心肌缺血再灌注损伤大鼠NO、NOS及腺苷A1受体的影响[J]. 中国中医急症, 2017, 26(4):565-567.
[30] 王璟, 杭涛, 江时森. 短暂缺血再灌注促进心肌葡萄糖转运体基因表达[J]. 医学研究生学报, 2005, 5(18):17-20.
[31] 钟承华. Na+-H+交换抑制剂对心肌缺血再灌注损伤的保护作用[J]. 中国动脉硬化杂志, 2004, 12(2):243-245.
[32] 罗红鹤, 庄梅, 汪礼旭,等. 先天性心脏病合并心功能不全患者心肌AMP分解途径的探讨[J]. 中国病理生理杂志, 2003, 19(1):68-71.
[23] Fang Li, QianXua, TingZhenga, FangHuangb, LintaoHanb. Metabonomic analysisof Allium macrostemonBunge as atreatmentfor acute myocardialischemiainrats J Pharm Biomed Anal. 2014;
88:225-34
[24] 钟丽华, 曹雪, 张翔, 李学奇, 白秀萍.心肌能量调控在缺血性心脏病治疗中的前景[J].黑龙江医学,2015,39(01);101-102
[25] 严洁, 刁利红, 易受乡, 常小荣, 林亚平, 杨孝芳.电针“内关”穴对心肌缺血再灌注损伤大鼠心肌能量代谢及组织形态学的影响[J].中国组织工程研究与临床康复.2007,11(47):9443-9447
[26] 陈存芳, 赵凤琴.能量代谢障碍与心肌缺血再灌注损伤[J].临床误诊误治.2009,22(02):77-79
[27] 赵珂, 罗勇.心肌葡萄糖转运体与心脏疾病[J].国际心血管病杂志.2011,38(4);220-223
[28] 周国鹏, 赵志杰.心肌缺血与糖代谢[J].中华老年心脑血管病杂志.2001,03(03):205-207
[29] 殷仁富,陈金明.心脏能量学-代谢与治疗[M].上海:第二军医大学出版社.2002:51-55.
[33] FANG L, QIAN X, TING Z, et al. Metabonomic analysis of Allium macrostemon Bunge as a treatment for acute myocardial ischemia in rats[J]. J Pharm Biomed Anal, 2014,88(88C):225-234.

 世界针灸学会联合会
世界针灸学会联合会