夹脊电针联合甲基强的松龙对急性脊髓损伤大鼠神经细胞毒性相关蛋白影响的实验研究
孙忠人,付 豪1,曾祥新2,吴 磊1,迟 蕾2
(1黑龙江中医药大学,哈尔滨150001;2黑龙江中医药大学附属第二医院,哈尔滨150001)
摘要: 目的: 观察夹脊电针联合甲基强的松龙对急性脊髓损伤大鼠脊髓组织NMDA-NR1和cleaved caspase-3蛋白表达的影响。方法:选用健康雌性Wistar大鼠120只,均分为5组,分别为正常组(Normal组)、假手术组(Sham组)、急性脊髓损伤组(ASCI组)、急性脊髓损伤+夹脊电针治疗+甲基强的松龙组(EA+MP组)及急性脊髓损伤+抑制剂组(MDL28170组),每组24只。每组又分别分为1d、3d、7d及14d四个亚组,每组6只。假手术组:仅暴露脊髓,不撞击损伤,手术后常规饲养;其余各组于模型成功后分别进行相应处置,选择BBB评分为1-3分的大鼠入组,手术大鼠单笼饲养。术后1d、3d、7d、14d采用BBB评分法观察大鼠运动功能;采用Western blot法检测脊髓组织NMDA-NR1和cleaved caspase-3蛋白表达。结果:BBB评分结果显示,与正常组和假手术组比较,模型组在各时间点BBB评分显著降低(P<0.05);与模型组比较,术后3d开始,夹脊电针联合甲强龙组和抑制剂组BBB评分显著升高(P<0.05);与抑制剂组比较,术后14d,夹脊电针联合甲强龙组BBB评分显著升高(P<0.05)。Western blot结果可知,与正常组和假手术组比较,模型组在各时间点NMDA-NR1和cleaved caspase-3蛋白表达均显著升高(P<0.05);与模型组比较,术后3d开始,夹脊电针联合甲强龙组和抑制剂组NMDA-NR1和cleaved caspase-3蛋白表达均显著降低(P<0.05);与抑制剂组比较,术后14d,夹脊电针联合甲强龙组NMDA-NR1和cleaved caspase-3蛋白表达显著降低(P<0.05)。结论:夹脊电针治疗能够显著改善急性脊髓损伤模型大鼠肢体运动功能,其作用机制可能与下调脊髓组织NMDA-NR1和cleaved caspase-3蛋白表达有关。
关键词:针灸推拿学;夹脊电针;急性脊髓损伤;甲基强的松龙;神经细胞毒性
Experimental Study on the Effect of Jiaji Electroacupuncture Combined with Methylprednisolone on Neurotoxicity-related Proteins in Rats with Acute Spinal Cord Injury
SUN Zhong-ren 1, LI Xiao-ning2, FU Hao 1, ZENG Xiang-xin 2, WU Lei 1, CHI Lei 2.
(1Heilongjiang University of Chinese Medicine, Harbin 150001,China; 2Second Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin 150001)
ABSTRACT: Objective To observe the effect of electric acupuncture combined with methylprednisolone on the expression of NMDA-NR1 and cleaved caspase-3 protein in spinal cord of rats with acute spinal cord injury. Methods:120 female Wister rats were randomly divided into normal group, Sham operation group,acute spinal cord injury group,EA+MP group and MDL28170 group.Each group was subdivided into 1d, 3d, 7d and 14d subgroups.Rats with BBB score of 1-3 were selected and the rats were treated for 14 days.After treatment,remove the injured spinal cord and use Western-blot to test the expression of NMDA-NR1 and cleaved caspase-3. Results:The BBB score shows that EA + MP group rats limb movement function score increases, it has significant difference (P < 0.05).Western blot test shows that the expression of NMDA-NR1 and cleaved caspase-3 has decreased . Conclusion Electrical acupuncture with MP can improve the ASCI rat clip ridge movement function score, at the same time reduce the expression of NMDA-NR1 and cleaved caspase-3.
Keywords: Acu-moxibustion and Tuina,Jiaji electroacupuncture, Acute spinal cord injury, Methylprednisolone, Neurotoxicity-related
人体在发生急性脊髓损伤( acute spinal cord injury,ASCI)后,由于神经细胞的再生能力相对较弱,一旦损伤恢复较难,因此通常会遗留相应的神经功能障碍[1]。夹脊电针对于急性脊髓损伤的疗效目前已得到大量的临床验证[2,3],但究其根本,目前对于其作用机制的研究并无确切结论。近年来的研究结果表明[4],神经毒性及细胞凋亡均为急性脊髓损伤后关键的损伤机制,是导致神经细胞损伤的两个重要途径。急性脊髓损伤后,介导神经细胞凋亡相关的毒性蛋白被激活,发生一系列造成神经细胞内部微环境的改变,引起受损神经细胞的继发性损伤,加重急性脊髓损伤的临床症状,增加其治疗难度。Caspases家族通过一系列的酶联反应介导细胞凋亡,从而产生相应神经功能缺损,NMDA是谷氨酸神经毒性通路中重要的蛋白之一,通过改变细胞内Ca2+的浓度,激活下游Calpain蛋白,该蛋白最终水解成多种蛋白水解物,加重细胞毒性损伤。甲基强的松龙可通过减轻神经水肿、调节免疫及炎性反应等机制改善神经细胞局部微环境,临床广泛应用于脊髓损伤急性期,但对于恢复期神经系统功能的恢复并无效果。本研究采用夹脊电针联合甲基强的松龙治疗急性脊髓损伤模型大鼠,通过评估其运动功能,检测脊髓内NMDA-NR1和cleaved caspase-3蛋白的表达情况,旨在为夹脊电针的临床应用提供更加明确的实验依据。
1材料与方法
1.1实验动物与分组
选用由辽宁长生生物技术有限公司(许可证号2015-0001)提供的健康雌性Wistar大鼠120只,体重在200±10g,每日固定人工照明(12:12光/暗周期),室内空调温度保持在23℃-25℃之间,相对湿度在40%-60%,保持实验动物水与粮食充足,实验中大鼠按照国际最新的实验动物使用和关怀指南进行。所有大鼠需要在实验室常规饲养适应1周。实验过程中严格按照《关于善待实验动物的指导性意见》[5]对动物进行处置。
1.2主要试剂与仪器
NMDA-NR1 antibody(BA0612,BOSTER,中国);cleaved caspase-3(WL01992,wanleibio,中国);全蛋白提取试剂盒(WLA019,wanleibio,中国)BCA蛋白浓度测定试剂盒(WLA 004,wanleibio,中国);PVDF膜(IPVH 00010,Millipore,美国)。水平摇床(WD-9405B,北京六一,中国);双垂直蛋白电泳仪(DYCZ-24 DN,北京六一,中国);凝胶成像系统(WD-9413 B型,北京六一,中国);超速冷冻离心机(H-2050 R,湖南湘仪,长沙);电针仪(KWD-808Ⅱ,英迪,中国);针灸针(0.30 mm×16 mm,华佗,中国)。
1.3模型制备及评定标准[6]
大鼠造模方法采用美国进口Impactor Model-Ⅲspinal cord contusion system打击器,在计算机智能操控下精准制作大鼠T10脊髓急性中度损伤模型。实验大鼠首先以10%水合氯醛溶液经腹腔注射法进行麻醉处理(3.5 ml/kg),然后使已麻醉的大鼠俯卧固定在试验台上,剪去其T10部位的毛发,暴露皮肤常规消毒,铺巾。以肋弓下缘作为第8肋骨的标记点,在背正中第10胸椎上1.5 cm至下1.5cm的范围作长约3 cm的纵行手术切口,切开皮下肌筋膜,暴露9~11胸椎棘突,钝性分离附近肌肉至关节突水平,充分暴露棘突和椎板。在第10胸椎部位施行椎板摘除术,暴露脊髓。将大鼠固定于打击器的基座上,设置打击器相关参数后打击脊髓。使打击棒以10 g×50 mm势能撞击以T10阶段为中心的脊髓,造成该段脊髓组织的急性中度损伤,最后以生理盐水冲洗伤口并清除残留血液,伤口部位常规分层缝合。当打击棒接触到脊髓与探针形成回路后会发出警报声;撞击完成后电脑描记撞击曲线,撞击高度和速度在正常误差范围内;大鼠可有身体痉挛性颤动及硬脊膜内充血或血肿。满足以上条件即为撞击成功。待大鼠清醒后,对其进行BBB评分,选择BBB评分在1~3分的大鼠入组。次日开始按摩大鼠腹部,协助排尿、排便,每日早晚各1次,持续至大鼠能自主排尿排便。
1.4干预方法
Normal组:常规饲养,正常捆绑,不做任何处置。
Sham组:手术后常规饲养,正常捆绑,其余不予任何处置。
ASCI组:模型制备成功后单笼饲养,正常捆绑,其余不予任何处置。
EA+MP组[7]:于模型制备成功后3h进行夹脊电针早期干预治疗,此后每日1次,直至疗程结束。针刺穴位选取T9、T11节段夹脊穴。操作方法:将0.35×13mm毫针直刺入所选穴位下4-5mm,接通电针仪正负两极,正极在上、负极在下,然后打开电流输出旋钮,电流输出强度以大鼠不出现强烈挣扎,背部肌肉轻微抽动为度(强度约0.4-0.6 mA)。电针仪脉冲波型:连续波,脉冲宽度:(0.5±0.15)ms,脉冲重复频率:密波频率为100 Hz,由电位器FREQ连续可调,脉冲峰值:Vp1≥40±10 V(在500Ω负载下),刺激时长为30min/次/日。
术后30min时,给予实验大鼠甲基强的松龙一次性注射。按30mg/kg与9L生理盐水配置成0.5ml注射液,给予大鼠腹腔注射;注射后正常捆绑,其余不予任何处置。
MDL28170组[8]:术后30min腹腔注射MDL 28170(1mg/kg),此后每日一次,直到疗程结束。正常捆绑,其余不予任何处置。
1.5观察指标及检测方法
各组实验大鼠于相应治疗时间点结束后,采用Basso、Beattie和Bresnahan(BBB)评分法观察各组大鼠运动功能恢复情况。评分后以水合氯醛麻醉(3.5 ml/kg),然后断头处死。于冰盒上快速取出损伤处脊髓,长度约4cm,从损伤中心处迅速切开,将损伤脊髓组织标记后放入EP管中于-80℃冰箱冻存,然后以Western blot方法检测其NMDA-NR1与cleaved caspase-3蛋白的表达情况。应用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带和β-actin的光密度值,以目标条带/β-actin条带作为该样品目的蛋白相对表达量。
1.6统计学处理
使用SPSS19.0统计软件对实验数据进行统计学处理。所有计数数据都用±S表示,先进行方差齐性检验。组间比较采用单因素方差分析(ANOVA),多个样本均数之间的多重分析行LSD-t检验,P<0.05即认为有统计学差异。
2结 果
2.1各组大鼠治疗前后BBB评分的变化
BBB评分结果显示,术后各时间点,ASCI组大鼠运动功能评分较其它组明显降低,与Sham组比较均有统计学意义(P<0.05)。与ASCI组相比,术后1d EA+MP组和MDL组大鼠肢体运动功能无明显差异(P>0.05)。术后3d、7d、14d,与ASCI组比较,EA+MP组、MDL组大鼠肢体运动功能评分升高,差异性显著(P<0.05)。术后14d,与MDL组比较,EA+MP组大鼠肢体运动功能评分升高,差异显著(P<0.05)。以上结果表明,EA+MP和MDL均能改善大鼠脊髓损伤后肢体运动功能,其中EA+MP组的效果最明显,具有统计学意义(P<0.05)。见表1。
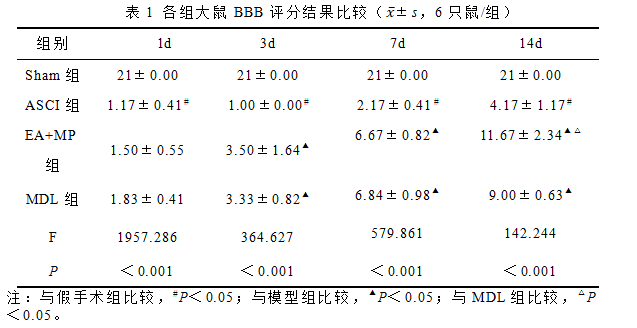
2.2 夹脊电针对急性脊髓损伤大鼠脊髓组织NMDA-NR1蛋白表达的影响
Western blot检测结果显示,与正常组和假手术组比较,模型组在各时间点NMDA-NR1蛋白表达均显著升高(P<0.05);与模型组比较,术后3d开始,夹脊电针联合甲强龙组和抑制剂组NMDA-NR1蛋白表达均显著降低(P<0.05);与抑制剂组比较,术后14d,夹脊电针联合甲强龙组NMDA-NR1蛋白表达显著降低(P<0.05)。以上结果表明,EA+MP可以抑制脊髓损伤后NMDA-NR1蛋白表达,而且其疗效优于MDL28170。见图1。


图1 各组大鼠脊髓组织NMDA-NR1蛋白表达结果比较(±s,6只鼠/组)
2.3 夹脊电针对急性脊髓损伤大鼠脊髓组织cleaved caspase-3蛋白表达的影响
Western blot检测结果显示,与正常组和假手术组比较,模型组在各时间点cleaved caspase-3蛋白表达均显著升高(P<0.05);与模型组比较,术后3d开始,夹脊电针联合甲强龙组和抑制剂组cleaved caspase-3蛋白表达均显著降低(P<0.05);与抑制剂组比较,术后14d,夹脊电针联合甲强龙组cleaved caspase-3蛋白表达显著降低(P<0.05)。以上结果表明,EA+MP可以抑制脊髓损伤后cleaved caspase-3蛋白表达,而且其疗效优于MDL28170。见图2。
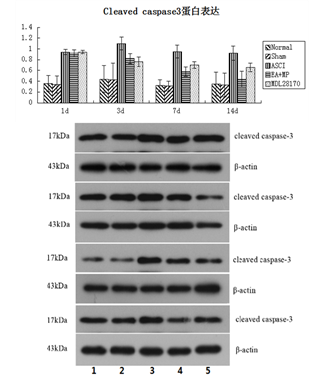
图2 各组大鼠脊髓组织cleaved caspase-3蛋白表达结果比较(±s,6只鼠/组)
3讨论
急性脊髓损伤(ASCI)的发病机制包括原发性因素和继发性因素两方面。在多方面因素的综合作用下,最终导致脊髓功能异常,从而导致相应的运动、感觉及自主神经等方面功能的减退[9]。ASCI后,受损的脊髓组织充血、水肿,影响局部血液循环并压迫脊髓本身及周围其他组织,造成脊髓局部机械性伤害;同时,受损的脊髓组织通过炎性反应机制、细胞毒性机制、一氧化氮机制等介导细胞凋亡,造成继发性损伤。目前研究证实,细胞毒性机制对神经细胞影响巨大。该机制主要通过4种通路影响细胞内环境。分别为谷氨酸脱氨酸转运体通路、AMPA化A受体通路、代谢性谷氨酸受体通路及NMDA 受体通路。其中NMDA通路最为重要。正常环境下,细胞内存在有一定量的兴奋性氨基酸,以维持细胞正常的生理活动。谷氨酸(Glu)即是一种兴奋性氨基酸,在Ca2+的参与下通过NMDAR传导神经冲动。ASCI后谷氨酸被大量释放从而过度激活NMDAR,Ca2+大量内流进细胞内致Ca2+超载,激活半化氨酸内切酶Calpain,Calpain水解成多种蛋白底物,进一步介导神经细胞调亡,加重受伤的脊髓组织继发性损伤。NMDAR共有NR1、NR2、NR3三个亚型,其中NR1作用最为广泛[10]。它是细胞毒性反应的核心蛋白,通过激活下游反应中的Calpain蛋白,介导细胞凋亡。Calpain蛋白与细胞结构稳定性密切相关,参与细胞生长、分化等多个过程,经NMDA-NR1激活后,迅速降解肌肉蛋白,溶解细胞骨架,致使神经细胞失去原有的稳定结构而破裂、坏死;同时,向下激活半胱氨酸蛋白酶(Caspase家族),进一步介导细胞凋亡。Caspase蛋白家族在细胞调亡过程中发挥重要作用,通过激活与DNA断裂相关的蛋白,选择性地切割某些蛋白质,使这些蛋白质分解或失活,影响细胞内DNA的合成过程,从而促使细胞凋亡。其中caspase-3是细胞洞亡过程中最重要的蛋白酶和关键酶,是蛋白酶级联反应的必经之路,是调亡路径中共同的下游效应部分,它的激活是细胞调亡的标志。研究证实,正常的脊髓组织中几乎没有caspase-3表达,而在ASCI后才大量出现,并在24-48h时达到高峰[11]。
本研究结果显示:模型组大鼠BBB评分较假手组显著降低(P<0.05);治疗后夹脊电针联合甲强龙组大鼠的BBB评分显著升高(P<0.05),且7d,14d的评分较之前更高,结果具有差异性(P<0.05),提示夹脊电针的疗效优于MDL28170,且疗效随着时间的增长而增长。同时,Western blot检测显示:夹脊电针联合甲强龙组大鼠脊髓组织中NMDA-NR1和cleaved caspase-3的表达均显著下降,证实夹脊电针联合甲基强的松龙能够通过切断脊髓急性损伤后NMDA-NR1蛋白通路,减少下游蛋白calpain-2的表达,从而减轻由该蛋白介导的细胞毒性作用。通过降低calpain-2对细胞骨架的分解作用,以维持神经细胞结构的稳定性;同时,减少caspase-3蛋白对于细胞中DNA的破坏,增强细胞的生存能力。通过降低这一系列蛋白的表达,减少细胞凋亡,保护受损的神经细胞,提高神经细胞存活率,从而促进神经功能的恢复。
综上所述,运用夹脊电针联合甲强龙治疗急性脊髓损伤模型大鼠可以显著改善大鼠的肢体运动功能,提高其生活质量。其作用机制与抑制细胞凋亡相关蛋白的表达有关,通过减轻细胞凋亡,保护受损神经细胞,从而减轻对脊髓组织的进一步损伤。
参考文献
[1]周红英,戚观树,侯群.脊髓损伤的发病机制及治疗进展[J].中华中医药学刊,2012,30(04):769-772.
[2] 施海燕,郝又国,陆伟伟. 脊髓损伤的康复治疗进展[J]. 中国康复,2012,27(01):44-46.
[3] 朱凯,伍光辉,罗红叶. 脊髓损伤的中西医治疗进展[J]. 湖南中医杂志,2014,30(02):154-156.
[4] Bracken M B. Steroids for acute spinal cord injury[M]// The Cochrane Library. John Wiley & Sons, Ltd, 2002:CD001046.
[5] 史晓萍,宗阿南,陶钧,等.《关于善待实验动物的指导性意见》的研究[J].中国医科大学学报,2007,(04):493. 2017-08-31.
[6] 李晓宁,吴磊,迟蕾,等. 不同治疗周期夹脊电针对急性脊髓损伤大鼠运动功能及细胞凋亡的影响[J]. 针刺研究,2016,41(06):492-496.
[7] 李晓宁,吴磊,梅继林,等. 夹脊电针联合甲强龙对急性脊髓损伤大鼠肢体运动功能及尼氏小体影响的实验研究[J]. 针灸临床杂志,2016,32(12):61-64+91.
[8] 綦雪巍. 夹脊电针联合MP调控NMDAR/Calpain通路相关蛋白抑制ASCI大鼠微环境神经细胞凋亡作用机制研究[D].黑龙江中医药大学,2016.
[9] 黄辉,余化霖. 继发性脊髓损伤发病机制的研究进展[J]. 医学综述,2013,19(07):1162-1165.
[10] Pérez-Otaño I, Ehlers M D. Learning from NMDA receptor trafficking: clues to the development and maturation of glutamatergic synapses[J]. Neurosignals, 2004, 13(4):175-189.
[11] Stennicke H R, Salvesen G S. Properties of the caspases[J]. Biochimica Et Biophysica Acta, 1998, 1387(1-2):17.

 世界针灸学会联合会
世界针灸学会联合会